Unterschied zwischen Natriumverborat und Percarbonat
Der Schlüsselunterschied Zwischen Natriumverborat und Percarbonat ist das Natrium-Perborat enthält ein Perboratanion, das aus einem cyclischen-B-O-O-Kern besteht, mit zwei Hydroxylgruppen, die an jedem Boratom gebunden sind, während Natriumpercarbonat einfach ein Addukt mit Wasserstoffperoxid ist.
Natrium -Perborat und Natriumpercarbonat sind anorganische Verbindungen mit Natrium als Kationen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Natriumvervischertage
3. Was ist Natriumpercarbonat
4. Seite an Seitenvergleich - Natrium -Perborat gegen Percarbonat in tabellarischer Form
5. Zusammenfassung
Was ist Natriumvervischertage?
Natriumverborat ist eine anorganische chemische Verbindung mit der chemischen Formel Nah2BO4 oder Na2H4B2O8. Wir können den Namen dieser Verbindung als PBS abkürzen. Diese Verbindung ist üblicherweise in ihrer wasserfreien Form oder in Form des Hexahydrat gefunden; e.G. Die Monohydratform von Natrium-Perborat wird als PBS-1 bezeichnet und die Tetrahydratform wird als PBS-4 bezeichnet. Beide Hydratformen von Natriumverborat sind weiße, geruchlos und wasserlösliche Feststoffe. Natrium -Perborat -Salz wird hauptsächlich bei der Herstellung von Waschmittel verwendet. Dort fungiert es als einer der Strände auf Peroxidbasis.
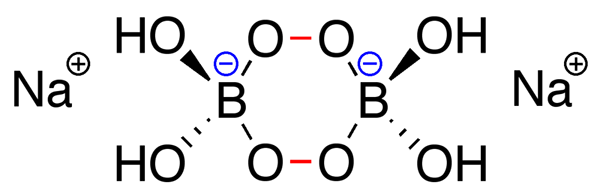
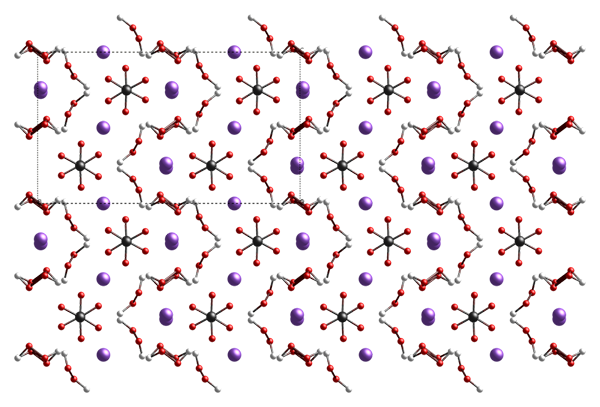
Abbildung 01: Struktur des Natriumverborats
Bei der Betrachtung der Grundstruktur von Natrium-Perborat unterscheidet sich sie von den chemischen Strukturen von Natriumpercarbonat und Natriumperphosphat, da es ein Perboratanion aufweist, das aus einem zyklischen-B-O-O-Core mit zwei Hydroxylgruppen besteht, die an jedem Boratom gebunden sind. Diese Ringstruktur verwendet normalerweise eine Stuhlkonformation.
Typischerweise unterzieht sich Natriumverborat leicht hydrolyse, wenn es zu Wasser zugesetzt wird, was Wasserstoffperoxid und Borat erzeugt. In einer Lösung des wässrigen Natriumverborats unterzieht sich das cyclische Anion in zwei Anionen von [B (OH) 3 (OOH)] einer Hydrolyse]-. Darüber hinaus kann sich die Monohydratform dieser Verbindung im Vergleich zur Tetrahydratform leicht auflösen und auch eine höhere Wärmestabilität aufweist. Daher können wir ein Monohydrat bilden, indem wir das Tetrahydrat -Natriumverborat erhitzen.
Bei der Betrachtung der Verwendung von Natrium -Perborat dient es als stabile Quelle für aktive Sauerstoff in vielen Reinigungsmitteln, Waschmittel, Reinigungsprodukten und Wäschebleichmittel. Außerdem ist es in einigen Zahnbleichformeln für Zahnbleichen für nicht-vital-Wurzelzähne vorhanden.
Was ist Natriumpercarbonat?
Natriumperkarbonat ist eine anorganische Verbindung mit der chemischen Formel Na2H3CO6. Wir können diese Verbindung als Addukt von Natriumcarbonat und Wasserstoffperoxid beobachten, dessen Formel als 2NA2CO3 ordnungsgemäß geschrieben werden kann.3H2O. Natriumperkarbonat ist ein farbloser, kristalliner, hygroskopischer Feststoff, der in Wasser löslich ist. Wir können diese Verbindung als SPC abkürzen. Normalerweise enthält diese Substanz 32.5% nach Gewicht des Wasserstoffperoxids.

Abbildung 02: Struktur von Natriumpercarbonat
Wenn Natriumpercarbonat in Wasser gelöst ist.
Bei der Betrachtung der Verwendung von Natriumpercarbonat ist es als Oxidationsmittel in Wäschereiprodukten, Reinigungsprodukten usw. wichtig. Es ist auch als Reinigungsmittel in vielen Heimbrauen nützlich. Darüber hinaus können wir diese Verbindung in der organischen Synthese als bequeme Quelle für wasserfreie Wasserstoffperoxid in bestimmten Lösungsmitteln verwenden.
Was ist der Unterschied zwischen Natriumverborat und Percarbonat?
Natrium -Perborat und Natriumpercarbonat sind anorganische Verbindungen mit Natrium als Kationen. Der Hauptunterschied zwischen Natrium-Perborat und Percarbonat besteht darin.
Nachfolgend Infografik tabuliert mehr Unterschiede zwischen Natrium -Perborat und Percarbonat für Seite an Seitenvergleich.

Zusammenfassung -Natriumverborat gegen Percarbonat
Natrium -Perborat und Natriumpercarbonat sind anorganische Verbindungen mit Natrium als Kation. Der Hauptunterschied zwischen Natrium-Perborat und Percarbonat besteht darin.
Referenz:
1. „Natriumpercarbonat.”Wikipedia, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Perborate Dimer" (Public Domain) über Commons Wikimedia
2. "Natrium-Percarbonat-textal-100K-2003-CM-3D-Balls" von Ben Mills-eigene Arbeit (Public Domain) über Commons Wikimedia


