Unterschied zwischen Redox- und Nicht -Redox -Reaktionen

Der Schlüsselunterschied Zwischen Redox- und Nicht -Redox -Reaktionen ist das Bei Redoxreaktionen ändert sich der Oxidationszustand einiger chemischer Elemente von einem Zustand in einen anderen Zustand, während sich bei Nicht -Redox -Reaktionen die Oxidationszustände chemischer Elemente nicht ändern.
Redox- und Nicht -Redox -Reaktionen sind zwei Haupttypen chemischer Reaktionen. Diese beiden Gruppen unterscheiden.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Redoxreaktionen
3. Was sind Nicht -Redox -Reaktionen
4. Seite an Seite Vergleich - Redox gegen Nicht -Redox -Reaktionen in tabellarischer Form
5. Zusammenfassung
Was sind Redoxreaktionen?
Redox-Reaktion ist eine Art chemischer Reaktion, bei der gleichzeitig Oxidation und Reduktion halbe Reaktionen auftreten. In dieser Reaktion betrachten wir Oxidation und Reduktion als komplementäre Prozesse. Hier ist Oxidation der Elektronenverlust oder der Anstieg des Oxidationszustands, während die Verringerung der Elektronengewinn oder der Abnahme des Oxidationszustands ist. Der Begriff „Redox“ ist eine Kurzform aus Reduktionsoxidationsprozessen.
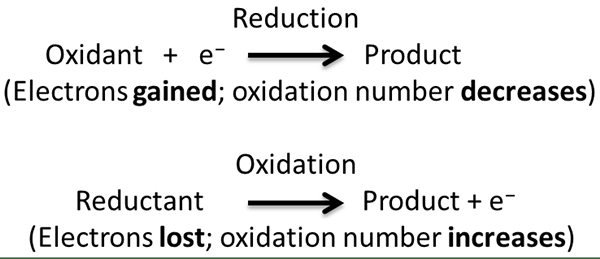
Während einer Redoxreaktion wird die chemische Verbindung/Reaktantin, die sich der Reduktion unterzieht. Dies liegt daran, dass das Oxidationsmittel dazu führt, dass die andere Verbindung oxidiert wird und umgekehrt.
Bei einer Redoxreaktion geschieht tatsächlich die Übertragung von Elektronen zwischen zwei Reaktanten durch Halbreaktionen. Wir können diesen Elektronentransfer leicht durch Beobachten der Oxidationszustände chemischer Elemente identifizieren. Während der Elektronentransfer nimmt der Oxidationszustand zu, wenn Elektronen verloren gehen. Es gibt verschiedene Arten von Redoxreaktionen, wie z.
Was sind Nicht -Redox -Reaktionen?
Nnonredox -Reaktionen sind chemische Reaktionen, bei denen keine Änderung der Oxidationszustände chemischer Elemente auftritt. Daher haben diese chemischen Reaktionen keine Halbreaktionen für Oxidation und Reduktion wie bei Redoxreaktionen. Mit anderen Worten, während des Fortschreitens der chemischen Reaktion treten Elektronenübertragungen auf.

Abbildung 02: NaOH- und HCL -Neutralisationsreaktion
Häufige Beispiele für Nicht-Redox-Reaktionen umfassen Neutralisationsreaktionen und doppelte Verschiebungsreaktionen.
Was ist der Unterschied zwischen Redox- und Nicht -Redox -Reaktionen?
Redox- und Nicht -Redox -Reaktionen sind zwei verschiedene Arten von chemischen Reaktionen. Der Schlüsselunterschied zwischen Redox- und Nicht -Redox -Reaktionen besteht darin, dass bei Redoxreaktionen der Oxidationszustand einiger chemischer Elemente von einem Zustand in einen anderen Zustand ändert. Darüber hinaus haben Redoxreaktionen Oxidations-Halbreaktionen und reduzieren die Halbreaktionen, während bei Nicht-Redox-Reaktionen keine bestimmten Halbreaktionen beobachtet werden können. Zersetzungsreaktionen, Verschiebungsreaktionen, Reaktionen gegenproportionaler Verhältnis zu usw. sind Beispiele für Redoxreaktionen, während Neutralisationsreaktionen, doppelte Verschiebungsreaktionen usw. sind Beispiele für Nicht -Redox -Reaktionen.
Die folgenden Infografik tabelliert die Unterschiede zwischen Redox- und Nicht -Redox -Reaktionen.

Zusammenfassung -Redox gegen Nicht -Redox -Reaktionen
Redox- und Nicht -Redox -Reaktionen sind zwei verschiedene Arten von chemischen Reaktionen. Der Schlüsselunterschied zwischen Redox- und Nicht -Redox -Reaktionen besteht darin, dass bei Redoxreaktionen der Oxidationszustand einiger chemischer Elemente von einem Zustand in einen anderen Zustand ändert.
Referenz:
1. „Oxidationsreduzierungsreaktionen.” Chemie -Libretexten, Libretexten, 15. August. 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Redox -Hälften" von Cameron Garnham - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia
2. "Neutralisationsreaktion zwischen Natriumhydroxid und Salzsäure" durch Bluescan SV.Wiki - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


