Unterschied zwischen SP3D2 und D2SP3 -Hybridisierung
Schlüsselunterschied - SP3D2 vs D2SP3 Hybridisierung
Es gibt hypothetische Strukturen, die als Orbitale in einem Atom bezeichnet werden, in dem sich Elektronen befinden. Verschiedene wissenschaftliche Entdeckungen haben verschiedene Formen für diese Orbitale vorgeschlagen. Atom -Orbitale können sich einem Prozess unterziehen, der als Hybridisierung bezeichnet wird. Hybridisierung von Orbitalen tritt auf, um geeignete Formen zu erhalten, die für die chemische Bindung erforderlich sind. Hybridisierung ist das Mischen von Atomorbitalen zur Bildung von Hybridorbitalen. sp3D2 und d2sp3 sind solche hybriden Orbitale. Der Schlüsselunterschied Zwischen sp3D2 und d2sp3Hybridisierung ist das sp3D2 Hybridisierung umfasst Atomorbitale derselben Elektronenschale, während D2sp3 Die Hybridisierung umfasst Atomorbitale von zwei Elektronenschalen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist SP3D2 -Hybridisierung
3. Was ist D2SP3 -Hybridisierung
4. Ähnlichkeiten zwischen SP3D2- und D2SP3 -Hybridisierung
5. Seite für Seitenvergleich - SP3D2 gegen D2SP3 -Hybridisierung in tabellarischer Form
6. Zusammenfassung
Was ist SP3D2 -Hybridisierung
sp3D2 Hybridisierung ist das Mischen von S-, P- und D -Atomorbitalen derselben Elektronenschale, um SP zu bilden3D2 Hybridorbitale. Dort mischen ein S atomic Orbital, drei p atomare Orbitale und zwei D -Atomorbitale miteinander. Diese Mischung führt zu sechs hybriden Orbitalen gleicher Größe und Form, unterscheidet sich jedoch von ihrer Ausrichtung.
Der sp3D2 Hybridorbitale sind in oktaedrischer Anordnung angeordnet. Diese Hybridorbitale haben 90Ö Winkel zwischen zwei Orbitalen in der oktaedrischen Anordnung. Die oktaedrische Anordnung zeigt eine quadratische Ebene mit vier hybriden Orbitalen und die beiden verbleibenden Orbitale sind oben und unter dieser quadratischen Ebene ausgerichtet (senkrecht zu dieser Ebene).
Beispiel
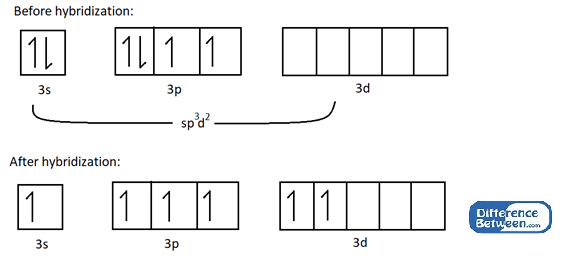
Betrachten wir ein Beispiel, um das SP zu verstehen3D2 Hybridisierung. Bsp.: SF6 -Molekül hat eine oktaedrische Form, da die 3S-, 3P- und 3D -Atomorbitale des Schwefelatoms (s) zu Fachspuren gemischt werden3D2 Hybridorbitale.

Abbildung 01: Elektronische Struktur des Schwefelatoms vor und nach der Hybridisierung.
Wie im obigen Bild gezeigt, führt die Hybridisierung in sechs ungepaarten Elektronen, die an chemischer Bindung mit sechs Fluoratomen teilnehmen können. Am wichtigsten ist, dass alle an dieser Hybridisierung beteiligten Atomorbitale in derselben Elektronenhülle liegen (im obigen Beispiel ist es n = 3 Elektronenschale).
Was ist D2SP3 -Hybridisierung?
D2sp3 Hybridisierung ist das Mischen von S- und P -Atomorbitalen derselben Elektronenschale mit D -Orbitalen einer anderen Elektronenschale, um D zu bilden D2sp3 Hybridorbitale. Diese Hybridisierung führt zu sechs Hybridorbitalen. Diese Hybridorbitale sind in einer oktaedrischen Geometrie angeordnet.
Am wichtigsten ist, dass bei dieser Hybridisierung die D-Atomorbitale aus einer anderen Elektronenschale (N-1-Elektronenschale) stammen, während S- und P-Atomorbitale die gleiche Elektronenschale haben. Betrachten wir ein Beispiel, um diese Hybridisierung zu verstehen. Die meisten Metallionenkomplexe bestehen aus D2sp3 Hybridisierte Orbitale.
Beispiel
Zum Beispiel nehmen Sie CO (NH3)3+ Komplex.
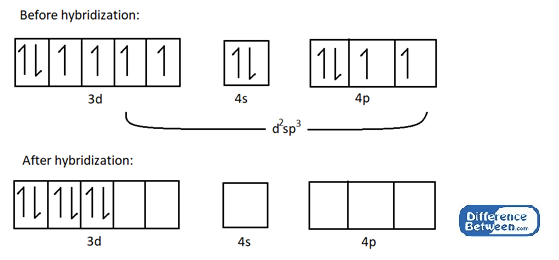
Abbildung 02: Elektronische Struktur des Kobalt -Atoms vor und nach der Hybridisierung.
Wie im obigen Bild gezeigt, gibt es nach Hybridisierung sechs leere Hybridorbitale im Kobaltatom. Diese leeren Orbitale können an der Bildung chemischer Bindungen der Koordination mit Liganden beteiligt sein (hier Ammoniakliganden = NH3).
Was sind die Ähnlichkeiten zwischen SP3D2 und D2SP3 -Hybridisierung?
- Sowohl SP3D2- als auch D2SP3 -Hybridisierungen führen zu einer oktaedrischen Geometrie.
- Sowohl SP3D2- als auch D2SP3 -Hybridisierungsgeometrien haben 90Ö Winkel zwischen hybriden Orbitalen.
- Sowohl SP3D2- als auch D2SP3 -Hybridisierung führen zu sechs Hybridorbitalen.
Was ist der Unterschied zwischen SP3D2 und D2SP3 -Hybridisierung?
SP3D2 gegen D2SP3 -Hybridisierung | |
| sp3D2 Hybridisierung ist das Mischen von S-, P- und D -Atomorbitalen derselben Elektronenschale, um SP zu bilden3D2 Hybridorbitale. | D2sp3 Hybridisierung ist das Mischen von S- und P -Atomorbitalen derselben Elektronenschale mit D -Orbitalen einer anderen Elektronenschale, um D zu bilden D2sp3 Hybridorbitale. |
| Nomenklatur | |
| sp3D2 Hybridisierung bildet sp3D2Hybridorbitale. | D2sp3 Hybridisierung d2sp3 Hybridorbitale. |
| Art der Atomorbitale | |
| sp3D2 Die Hybridisierung umfasst Atomorbitale derselben Elektronenschale. | D2sp3 Die Hybridisierung umfasst Atomorbitale von zwei Elektronenschalen. |
| D Orbitale | |
| sp3D2 Hybridisierung umfasst die Atomorbitale von N -Elektronenschale. | D2sp3 Die Hybridisierung umfasst die Atomorbitale von N-1-Elektronenschale. |
Zusammenfassung - SP3D2 vs D2SP3 Hybridisierung
sp3D2 Hybridisierung und d2sp3 Hybridisierung sind verwirrende Begriffe, die in den meisten Fällen austauschbar verwendet werden. Diese sind in vielerlei Hinsicht unterschiedlich. Der Schlüsselunterschied zwischen SP3D2 und d2sp3Hybridisierung ist das, sp3D2 Hybridisierung umfasst Atomorbitale derselben Elektronenschale, während D2sp3 Die Hybridisierung umfasst Atomorbitale von zwei Elektronenschalen.
Laden Sie die PDF -Version von SP3D2 gegen D2SP3 -Hybridisierung herunter
Sie können die PDF -Version dieses Artikels herunterladen und sie für Offline -Zwecke gemäß Citation Note verwenden. Bitte laden Sie die PDF -Version hier herunter: Unterschied zwischen SP3D2 und D2SP3 -Hybridisierung
Referenz:
1.„8.2: Hybridatomare Orbitale.”Chemistry Libretexten, Libretexte, 30. August. 2017. Hier verfügbar


