Unterschied zwischen Tartarsäure und Zitronensäure
Der Schlüsselunterschied Zwischen Tartarsäure und Zitronensäure befindet sich die Weinsäure (Sahne von Zahnstein, C4H6Ö6) ist dipotisch, während die Zitronensäure (C6H8Ö7) ist triprot. Tartarsäure ist im Handel als weißes Pulver erhältlich und hat eine sehr schlechte Wasserlöslichkeit, während Zitronensäure eine geruchlose Verbindung ist und als feste kristalline Verbindung erhältlich ist.
Tartarsäure und Zitronensäure sind saure Verbindungen, da ihre Carboxylgruppen die Wasserstoffatome in sie auf das Medium freisetzen können. Beide Verbindungen sind in Pflanzen vorhanden, insbesondere in Früchten. Tartarsäure ist in Trauben vorhanden, während Zitronensäure in Zitronen vorhanden ist.

INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Tartarsäure
3. Was ist Zitronensäure
4. Seite an Seite Vergleich -Tartarsäure gegen Zitronensäure in tabellarischer Form
5. Zusammenfassung
Was ist Tartarsäure?
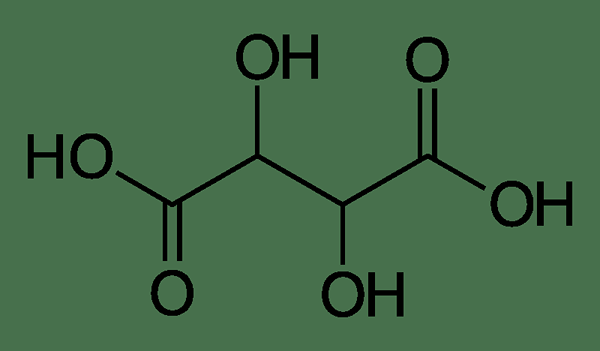
Tartarsäure, allgemein bekannt als Sahne von Zahnstein, ist eine organische Verbindung mit der chemischen Formel C4H6Ö6. Der IUPAC -Name dieser Säure ist 2,3-dihydroxybutandiosäure. Die Molmasse dieser Säure beträgt 150.08 g/mol und es hat eine sehr schlechte Wasserlöslichkeit. Die Verbindung ist als weißes Pulver erhältlich und in der konzentrierten Form gereizt.
Tartarsäure ist natürlich in Trauben erhältlich und bildet während des Weinherstellungsprozesses unter Verwendung von Trauben spontan. Darüber hinaus ist es in seiner Kaliumsalzform - Kaliumbitartrat - üblich. Backpulver, ein häufiger Sauerteig -Wirkstoff in der Lebensmittelproduktion, ist eine Mischung aus Natriumbicarbonat und Kaliumbitartrat. Darüber hinaus fungieren Tartarsäure als Antioxidans in einigen Lebensmitteln.
Tartarsäure ist eine Alpha-Hydroxy-Carboxylsäure. Diese Kategorisierung ist auf die beiden Carboxylsäuregruppen in diesem Molekül zurückzuführen, und beide Gruppen haben eine Hydroxylgruppe in ihrer Alpha -Kohlenstoffposition. Darüber hinaus ist das Molekül dipratisch, da es möglich ist, die Wasserstoffatome in den beiden Carboxylgruppen als Protonen zu entfernen.

Abbildung 1: Tartarsäuremolekül
Das natürlich vorkommende Tartarsäuremolekül ist eine chirale Verbindung. Das heißt, dieses Molekül hat Enantiomere; Es hat L und D Enantiomere. Das natürlich vorkommende Enantiomer ist die L-(+)-Tartarsäure. Diese Enantiomere sind optisch aktiv, weil sie das ebene polarisierte Licht drehen können.
Was ist Zitronensäure?
Zitronensäure ist eine organische Verbindung mit der chemischen Formel C6H8Ö7. Der IUPAC -Name dieser Verbindung ist 2-Hydroxypropan-1,2,3-Tricarboxylsäure. Seine Molmasse ist 192.12 g/mol und der Schmelzpunkt ist 156 ° C. Es ist eine geruchlose Verbindung und ist als feste kristalline Verbindung erhältlich.
Das Zitronensäuremolekül hat eine drei Carboxylsäuregruppe, die darauf hinweist. Die Säure ist triprot, da das Säuremolekül drei Protonen pro Molekül freisetzen kann (die drei Carboxylsäuregruppen können die Wasserstoffatome in ihnen als Protonen freisetzen).
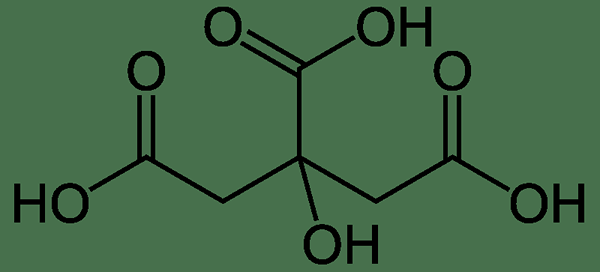
Abbildung 2: Zitronensäuremolekül
Zitronensäure ist natürlich in Zitrone und anderen Früchten in der Familie Rutaceae erhältlich, ich.e., Zitrusfrüchte. Es ist eine Haut und ein Augenreizend. Diese Verbindung hat unterschiedliche Anwendungen wie Lebensmittelzusatzstoffe, Getränke, Chelatmakler, Zutat in bestimmten Kosmetika usw.
Was ist der Unterschied zwischen Tartarsäure und Zitronensäure?
Tartarsäure gegen Zitronensäure | |
| Weinsäure ist eine organische Verbindung mit der chemischen Formel C4H6Ö6. | Zitronensäure ist eine organische Verbindung mit der chemischen Formel C6H8Ö7. |
| IUPAC -Name | |
| 2,3-dihydroxybutandiosäure | 2-Hydroxypropan-1,2,3-Tricarboxylsäure |
| Molmasse | |
| 150.08 g/mol | 192.12 g/mol |
| Schmelzpunkt | |
| 206 ° C (in racemischer Mischung aus D- und L -Enantiomeren) | 153 ° C |
| Siedepunkt | |
| 275 ° C | 310 ° C |
| Anzahl der Carboxylsäuregruppen | |
| Hat zwei Carboxsäuregruppen | Hat drei Carboxsäuregruppen |
| Vorhandensein von Enantiomeren | |
| Zwei Enantiomer-Formen: L-Tartarsäure und D-Tartarsäure | Keine Enantiomere |
| Vorhandensein einer Hydroxylgruppe | |
| Hat zwei Hydroxylgruppen | Hat eine Hydroxylgruppe |
| Natürliche Quelle | |
| Natürlich in Früchten wie Trauben erhältlich | In Zitrusfrüchten auf natürliche Weise erhältlich |
| Handelsprodukt | |
| Verkauft als Backpulver | Verkauft als kristalliner weißer Feststoff |
| Anwendungen | |
| Wird in der pharmazeutischen Industrie und als Chelatmakler für Kalzium und Magnesium verwendet | Wird als Zutat für Lebensmittel und Getränke, als Chelatmakler, bei der Herstellung von Arzneimitteln und Kosmetika usw. verwendet, usw. |
Zusammenfassung -Tartarsäure gegen Zitronensäure
Der Schlüsselunterschied zwischen Tartarsäure und Zitronensäure besteht darin. Das heißt, das Tartarsäuremolekül hat zwei Wasserstoffatome, die als Protonen freigesetzt werden können, während Zitronensäuremolekül drei Wasserstoffatome als Protonen enthält. Beide sauren Verbindungen sind üblicherweise in Pflanzen erhältlich, insbesondere in Früchten; Trauben sind jedoch die gemeinsame Quelle für Tartarsäure, während Zitrusfrüchte die gemeinsame Quelle für Zitronensäure sind.
Referenz:
1. "Weinsäure.”Wikipedia, Wikimedia Foundation, 22. April. 2018, hier erhältlich.
2. "Zitronensäure.”Wikipedia, Wikimedia Foundation, 17. April. 2018, hier erhältlich.
3. Brown, William H. "Weinsäure.”Encyclopædia Britannica, Inc., 17 Apr. 2016, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Tartarsäure" von Jaga-selbstgemacht mit Bkchem und Inkscape (CC BY-SA 3.0) über Commons Wikimedia
2. "Zitronensäure - Zitronensäure" von Neurotiker - eigene Arbeit (Public Domain) über Commons Wikimedia


