Unterschied zwischen thermodynamischer und kinetischer Stabilität
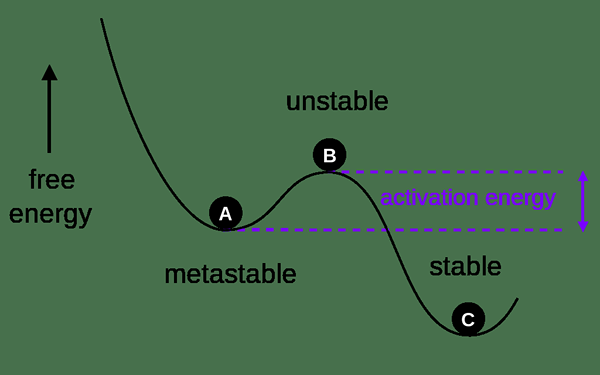
Der Schlüsselunterschied Zwischen thermodynamischer und kinetischer Stabilität ist das Die thermodynamische Stabilität bezieht sich auf den Status von Produkten, während sich die kinetische Stabilität auf den Status von Reaktanten bezieht.
Thermodynamische und kinetische Stabilität sind zwei wichtige chemische Begriffe, die Systeme mit chemischen Reaktionen beschreiben. Die thermodynamische Stabilität ist die Stabilität des niedrigsten Energiezustands eines Systems, während die kinetische Stabilität die Stabilität des höchsten Energiezustands eines Systems ist. Darüber hinaus beschreibt der thermodynamische Zustand einen Gleichgewichtszustand eines Systems, während ein kinetischer Zustand die Reaktivität eines Systems beschreibt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist thermodynamische Stabilität
3. Was ist kinetische Stabilität
4. Seite an Seite Vergleich -thermodynamische gegen kinetische Stabilität in tabellarischer Form
5. Zusammenfassung
Was ist thermodynamische Stabilität?
Die thermodynamische Stabilität ist die Stabilität des niedrigsten Energiezustands eines Systems. Es ist auch als chemische Stabilität im allgemeinen Gebrauch bekannt. Der niedrigste Energiezustand eines Systems ist dort, wo die optimale Produktausbeute erhalten wird. Dies bedeutet, dass die thermodynamische Stabilität gewonnen wird, wenn das System in einen Gleichgewichtszustand kommt. Manchmal tritt diese Stabilität auf, wenn es ein dynamisches Gleichgewicht gibt, bei dem die einzelnen Atome und Moleküle dazu neigen, ihre Form zu ändern, und die Gesamtänderung bei Nullpunkt hält.

Abbildung 01: Stabilität von Produkten im Gleichgewichtszustand
Das Gegenteil der thermodynamischen Stabilität ist die „kinetische Stabilität“, die die Reaktivität eines Systems und nicht den Gleichgewichtszustand dieses Systems beschreibt.
Was ist kinetische Stabilität?
Die kinetische Stabilität ist die Stabilität des höchsten Energiezustands eines Systems. Das bedeutet; Kinetische Stabilität tritt auf, wenn ein optimaler Reaktantenprozentsatz im System vorliegt. Dies liegt daran. Die kinetische Stabilität eines Systems hängt somit mit der Reaktivität der Reaktanten zusammen. Darüber hinaus benötigen die Reaktanten normalerweise einen Energieeinsatz, um die Reaktion von der kinetischen Stabilität bis zur thermodynamischen Stabilität zu bewegen.
Was ist der Unterschied zwischen thermodynamischer und kinetischer Stabilität?
Thermodynamische und kinetische Stabilität sind wichtige chemische Begriffe in der physikalischen Chemie. Der Hauptunterschied zwischen thermodynamischer und kinetischer Stabilität besteht darin, dass die thermodynamische Stabilität den Status von Produkten bezieht, während sich die kinetische Stabilität auf den Status von Reaktanten bezieht. Normalerweise haben Reaktanten einer Reaktion eine hohe Energie im Vergleich zum Energieniveau der Produkte. Und dies ist der Grund, warum Reaktanten dazu neigen, in niedrige Energieprodukte umzuwandeln, um stabilisiert zu werden.
Chemische Reaktionen erfordern normalerweise einen Energieeinsatz, um das System von der kinetischen Stabilität bis zur thermodynamischen Stabilität zu bewegen, in der optimale Produkte hergestellt werden. Daher bezieht sich der Begriff thermodynamisch auf den Gleichgewichtszustand eines Systems, während sich der Begriff kinetisch auf die Reaktivität eines Systems bezieht. Manchmal gibt die thermodynamische Stabilität die Stabilität entweder einer Gleichgewichtsreaktion oder einer Nicht-Gleichgewichtsreaktion.
Die folgende Tabelle fasst den Unterschied zwischen thermodynamischer und kinetischer Stabilität zusammen.

Zusammenfassung -thermodynamische gegen kinetische Stabilität
Thermodynamische und kinetische Stabilität sind wichtige chemische Begriffe in der physikalischen Chemie. Die thermodynamische Stabilität ist die Stabilität des niedrigsten Energiezustands eines Systems, während die kinetische Stabilität die Stabilität des höchsten Energiezustands eines Systems ist. Der Hauptunterschied zwischen thermodynamischer und kinetischer Stabilität besteht darin, dass die thermodynamische Stabilität den Status von Produkten bezieht, während sich die kinetische Stabilität auf den Status von Reaktanten bezieht. In der Regel benötigt ein System eine gewisse Eingabeenergie, um das System von der kinetischen Stabilität bis zur thermodynamischen Stabilität durch die Reaktivität der Reaktanten zu bewegen.
Referenz:
1. Anthony, Tag. „Kinetische Stabilität.” School of Crystallography, Birbeck University, 1996, hier erhältlich.
2. „Thermodynamische Stabilität.” ein Überblick | Sciencedirect -Themen, Hier verfügbar.
Bild mit freundlicher Genehmigung:
1. "Thermodynamische Stabilität en" von Woudloper - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


