Unterschied zwischen Thomson und Rutherford Modell des Atoms

Schlüsselunterschied - Thomson gegen Rutherford -Modell des Atoms
Der Hauptunterschied zwischen Thomson und Rutherford -Modell des Atoms ist das Das Thomson -Modell des Atoms enthält keine Details über den Nucleus wohingegen Das Rutherford -Modell des Atoms erklärt den Kern eines Atoms. J.J. Thomson war der erste, der 1904 das subatomare Teilchen namens Electron entdeckte. Das von ihm vorgeschlagene Modell wurde als "Pflaumenpudding -Modell des Atoms" bezeichnet. Aber 1911 kam Ernest Rutherford nach seiner Entdeckung des Atomkerns 1909 ein neues Modell für das Atom.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist das Thomson -Modell des Atoms
3. Was ist Rutherford -Modell des Atoms
4. Seite an Seitenvergleich - Thomson gegen Rutherford -Modell des Atoms in tabellarischer Form
5. Zusammenfassung
Was ist das Thomson -Modell des Atoms?
Das Thomson -Atommodell heißt Plum Pudding -Modell Weil es besagt, dass das Atom wie ein Pflaumenpudding aussieht. Die einzigen bekannten Details über das Atom zu dieser Zeit waren,
- Atome bestehen aus Elektronen
- Elektronen sind negativ geladene Partikel
- Atome sind neutral aufgeladen
Da Elektronen negativ aufgeladen sind, schlug Thomson vor, dass es eine positive Ladung geben sollte, um die elektrische Ladung des Atoms zu neutralisieren. Das Thomson -Modell des Atoms erklärt, dass Elektronen in ein positiv geladenes festes Material eingebettet sind, das kugelförmige Form hat. Diese Struktur sieht aus wie ein Pudding mit aufgebetteten Pflaumen und wurde als Plum -Pudding -Modell von Atom bezeichnet. Dies zeigte die Annahme, dass ein Atom neutral aufgeladen ist, da dieses Modell die negativen Ladungen von Elektronen durch die positive Ladung der festen Kugel neutralisiert werden. Obwohl dieses Modell bewiesen hat, dass Atome neutral aufgeladen sind, wurde es nach der Entdeckung des Kerns abgelehnt.

Abbildung 01: Thomson -Modell des Atoms
Was ist Rutherford -Modell des Atoms?
Nach dem Rutherford-Modell des Atoms war das sogenannte Pflaumenpudding-Modell von Thomson falsch. Das Rutherford -Atommodell heißt ebenfalls Nuklearmodell Weil es Details zum Kern eines Atoms enthält.
Das berühmte Experiment namens „Rutherford Gold Foil Experiment“ führte zur Entdeckung des Kerns. In diesem Experiment wurden Alpha -Partikel durch eine Goldfolie bombardiert; Es wurde erwartet, dass sie direkt durch die Goldfolie gehen,. Aber statt der geraden Eindringung verwandelten sich Alpha -Partikel in verschiedene Richtungen.
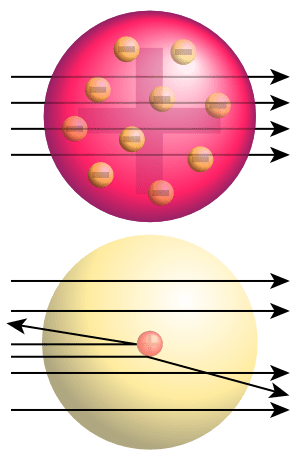
Abbildung 02: Rutherford Gold Folienexperiment Spitze: Erwartete Ergebnisse (gerade Penetration) Unterseite: Beobachtete Ergebnisse (Ablenkung einiger Partikel)
Dies zeigte, dass es etwas Festes mit einer positiven Ladung in dieser Goldfolie gibt, die eine Kollision mit Alpha -Partikeln verursacht. Rutherford nannte diesen positiven Kern als Kern. Dann schlug er das Atommodell für das Atom vor; Es bestand aus einem positiv geladenen Kern und negativ geladenen Elektronen, die den Kern umgeben. Er schlug auch vor, dass Elektronen in bestimmten Entfernungen in Orbitalen um den Kern liegen. Dieses Modell wird auch genannt Planetenmodell Weil Rutherford vorschlug, dass sich die Elektronen um den Kern befinden, ähnlich den Planeten um die Sonne.
Nach diesem Modell,
- Das Atom besteht aus einem positiv geladenen Zentrum, das als Kern bezeichnet wird. Dieses Zentrum enthielt die Masse des Atoms.
- Die Elektronen befinden sich außerhalb des Kerns in Orbitalen in beträchtlicher Entfernung.
- Die Anzahl der Elektronen entspricht der Anzahl der positiven Ladungen (später als Protonen genannte Protonen) im Kern.
- Das Volumen des Kerns ist im Vergleich zum Volumen des Atoms vernachlässigbar. Daher ist der größte Teil des Raums im Atom leer.
Dieses Rutherford -Modell von Atom wurde jedoch ebenfalls abgelehnt, da es nicht erklären konnte, warum die Elektronen und die positiven Ladungen im Kern nicht voneinander angezogen werden.

Abbildung 03: Rutherford -Atommodell
Was ist der Unterschied zwischen Thomson und Rutherford Modell des Atoms?
Thomson gegen Rutherford Modell des Atoms | |
| Thomson -Modell des Atoms ist das Modell, das besagt. | Das Rutherford -Modell des Atoms ist das Modell, das erklärt, dass sich in der Mitte des Atoms ein Kern befindet und sich die Elektronen um den Kern befinden. |
| Kern | |
| Das Thomson -Modell des Atoms gibt keine Details über den Kern an. | Das Rutherford -Modell des Atoms enthält Details über den Kern eines Atoms und seinen Standort im Atom. |
| Ort der Elektronen | |
| Laut Thomson -Atommodell sind die Elektronen in ein festes Material eingebettet. | Das Modell von Rutherford sagt, dass sich die Elektronen um den Kern befinden. |
| Orbitale | |
| Das Thomson -Modell des Atoms gibt keine Details zu Orbitalen an. | Das Rutherford -Modell von Atom erklärt Orbitale und die Elektronen in diesen Orbitalen. |
| Masse | |
| Das Thomson -Modell des Atoms erklärt, dass die Masse eines Atoms die Masse des positiv geladenen Feststoffs ist, in dem Elektronen eingebettet sind. | Nach dem Rutherford -Atommodell konzentriert sich die Masse eines Atoms im Kern des Atoms. |
Zusammenfassung -Thomson gegen Rutherford -Modelle von Atom
Thomson und Rutherford -Modelle des Atoms waren die frühesten Modelle, um die Struktur eines Atoms zu erklären. Nach der Entdeckung des Elektrons durch j.J. Thomson schlug er ein Modell vor, um die Struktur des Atoms zu erklären. Später entdeckte Rutherford den Kern und führte ein neues Modell mit Elektronen und Kern ein. Der Hauptunterschied zwischen Thomson und Rutherford -Modell des Atoms besteht darin, dass Thomson -Modell des Atoms keine Details über den Kern enthält, während das Rutherford -Modell des Atoms den Kern des Atoms erklärt.
Laden Sie die PDF -Version von Thomson gegen Rutherford -Modelle von Atom herunter
Sie können die PDF -Version dieses Artikels herunterladen und ihn für Offline -Zwecke gemäß Zitatnotizen verwenden. Bitte laden Sie die PDF -Version hier den Unterschied zwischen Thomson und Rutherford -Modell des Atom herunter.
Referenz:
1.”Rutherford Modell des Atoms: Definition & Diagramm." Lernen.com. N.D. Netz. Hier verfügbar. 06. Juni 2017.
2. Brescia, Frank. Grundlagen der Chemie: Eine moderne Einführung (1966). Elsevier, 2012. Drucken.
3. Goldsby, Kenneth. Chemie. 12. ed. New York: McGraw-Hill, 2015. Drucken.
Bild mit freundlicher Genehmigung:
1. "Plum Pudding Atom" (Public Domain) über Commons Wikimedia
2. "Rutherford Atom" von eigener Arbeit (Createjoder XD XD) (CC BY-SA 3.0) über Commons Wikimedia
3. "Rutherford Gold Foil Experiment Ergebnisse" von Benutzer: FastFission Own Work (Public Domain) über Commons Wikimedia


