Unterschied zwischen Trypsin und Chymotrypsin
Schlüsselunterschied - Trypsin VS Chymotrypsin
Proteinverdauung ist ein sehr wichtiger Prozess beim Gesamtverdauungsverfahren in lebenden Organismen. Komplexe Proteine werden in seine Monomere von Aminosäuren verdaut und über den Dünndarm absorbiert. Proteine sind wesentlich, da sie eine wichtige funktionelle und strukturelle Rolle in einem Organismus dienen. Die Proteinverdauung erfolgt über Proteinverdauungsenzyme, zu denen Trypsin, Chymotrypsin, Peptidasen und Proteasen gehören. Trypsin ist ein proteingigestes Enzym, das die Peptidbindung an den basischen Aminosäuren spaltet, zu denen Lysin und Arginin gehören. Chymotrypsin ist auch ein proteingigestes Enzym, das die Peptidbindung an aromatischen Aminosäuren wie Phenylalanin, Tryptophan und Tyrosin spaltet. Der Schlüsselunterschied Zwischen Trypsin und Chymotrypsin ist die Position der Aminosäure, in der sie sich im Protein spaltet. Trypsin spaltet sich an grundlegenden Aminosäurepositionen, während Chymotrypsin an aromatischen Aminosäurepositionen spaltet.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Trypsin?
3. Was ist Chymotrypsin
4. Ähnlichkeiten zwischen Trypsin und Chymotrypsin
5. Seite an Seite Vergleich - Trypsin gegen Chymotrypsin in tabellarischer Form
6. Zusammenfassung
Was ist Trypsin??
Trypsin ist ein 23.3 KDA -Protein, das zur Familie der Serinproteasen und ihren Hauptsubstraten gehört, sind grundlegende Aminosäuren. Diese grundlegenden Aminosäuren umfassen Arginin und Lysin. Trypsin wurde 1876 von Kuhne entdeckt. Trypsin ist ein globuläres Protein und existiert in seiner inaktiven Form, die Trypsinogen - Zymogen ist. Der Wirkungsmechanismus von Trypsin basiert auf der Serinproteaseaktivität.
Trypsin spaltet am terminalen Ende der grundlegenden Aminosäuren. Dies ist eine Hydrolysereaktion und findet bei einem pH -Wert statt.0 im Dünndarm. Die Aktivierung von Trypsinogen erfolgt durch die Entfernung des terminalen Hexapeptids und erzeugt die aktive Form; Trypsin. Active Trypsin ist von zwei Haupttypen; α - Trypsin und β -Trypsin. Sie unterscheiden sich in ihrer thermischen Stabilität und ihrer Struktur. Das aktive Zentrum von Trypsin enthält Histidin (H63), Asparaginsäure (D107) und Serin (S200).
Abbildung 01: Trypsin
Die enzymatische Wirkung von Trypsin wird durch DFP, Aprotinin, AG gehemmt+, Benzamidin und EDTA. Die Anwendungen von Trypsin umfassen die Dissoziation von Gewebe, Trypsinisierung in der Tierzellkultur, Tryptic Mapping, in vitro Proteinstudien, Fingerabdruck und in Gewebekulturanwendungen.
Was ist Chymotrypsin?
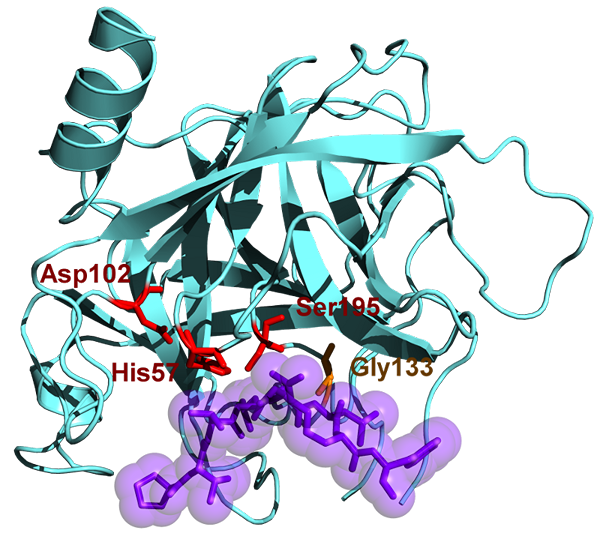
Chymotrypsin hat ein Molekulargewicht von 25.6 kDa und gehört zur Familie der Serinprotease, und es ist eine Endopeptidase. Chymotrypsin existiert in seiner inaktiven Form, die Chymotrypsinogen ist. Chymotrypsin wurde im Jahr 1900 entdeckt. Chymotrypsin hydrolysiert die Peptidbindungen an den aromatischen Aminosäuren. Diese aromatischen Substrate umfassen Tyrosin, Phenylalanin und Tryptophan. Die Substrate dieses Enzyms sind hauptsächlich in den L-Isomeren und wirken leicht auf die Amide und Ester von Aminosäuren. Der optimale pH -Wert, bei dem Chymotrypsin wirkt, ist 7.8 - 8.0. Es gibt zwei Hauptformen von Chymotrypsin wie Chymotrypsin A und Chymotrypsin B und unterscheiden sich in den strukturellen und proteolytischen Eigenschaften leicht. Das aktive Zentrum von Chymotrypsin enthält eine katalytische Triade und besteht aus Histidin (H57), Asparaginsäure (D102) und Serin (S195).

Abbildung 02: Chymotrypsin
Die Aktivatoren von Chymotrypsin sind Cetyltrimethylammoniumbromid, Dodecyltrimethylammoniumbromid, Hexadecyltrimethylammoniumbromid und Tetrabutylammoniumbromid. Die Inhibitoren von Chymotrypsin sind Peptidylaldehyde, Boronsäuren und Cumarinderivate. Chymotrypsin wird kommerziell bei der Peptidsynthese, Peptidkartierung und Peptidfingerabdruck verwendet.
Was sind die Ähnlichkeiten zwischen Trypsin und Chymotrypsin?
- Beide Enzyme sind Serinproteasen.
- Beide Enzyme spalten Peptidbindungen.
- Beide Enzyme wirken im Dünndarm.
- Beide Enzyme existieren in seiner inaktiven Form als Zymogene.
- Beide Enzyme bestehen aus einer katalytischen Triade, die Histidin, Asparagsäure und Serin in ihrem aktiven Standort enthält.
- Beide Enzyme wurden ursprünglich entdeckt und aus Rindern extrahiert.
- Die Produktion beider Enzyme erfolgt derzeit durch rekombinante DNA -Techniken.
- Beide Enzyme wirken auf einen optimalen grundlegenden pH -Wert.
- Beide Enzyme werden verwendet in vitro In verschiedenen Branchen.
Was ist der Unterschied zwischen Trypsin und Chymotrypsin?
Trypsin gegen Chymotrypsin | |
| Trypsin ist ein proteingigestes Enzym, das die Peptidbindung an den grundlegenden Aminosäuren wie Lysin und Arginin spaltet. | Chymotrypsin, das auch ein proteinverdauendes Enzym ist. |
| Molekulargewicht | |
| Das Molekulargewicht von Trypsin beträgt 23.3 k da. | Das Molekulargewicht von Chymotrypsin beträgt 25.6 k da. |
| Substrate | |
| Komplexe Proteine werden in seine Monomere von Aminosäuren verdaut und über den Dünndarm absorbiert. | Aromatische Aminosäuren -Substrate wie Tyrosin, Tryptophan und Phenylalanin wirken auf Chymotrypsin. |
| Zymogenform des Enzyms | |
| Trypsinogen ist die inaktive Form von Trypsin. | Chymotrypsinogen ist die inaktive Form von Chymotrypsin. |
| Aktivatoren | |
| Lanthanides sind Aktivatoren von Trypsin. | Cetyltrimethylammoniumbromid, Dodecyltrimethylammoniumbromid, Hexadecyltrimethylammoniumbromid und Tetrabutylammoniumbromid sind Aktivatoren von Chymotrypsin sind. |
| Inhibitoren | |
| DFP, Aprotinin, AG+, Benzamidin und EDTA sind Inhibitoren von Trypsin. | Peptidylaldehyde, Boronsäuren und Cumarinderivate sind Inhibitoren von Chymotrypsin. |
Zusammenfassung -Trypsin VS Chymotrypsin
Peptidasen oder proteolytische Enzyme spalten Proteine über die Hydrolyse der Peptidbindung. Trypsin spaltet die Peptidbindung an basischen Aminosäuren, während Chymotrypsin die Peptidbindung an aromatischen Aminosäureresten spaltet. Beide Enzyme sind Serinpeptidasen und wirken im Dünndarm in einer grundlegenden pH -Umgebung. Gegenwärtig ist viel Forschung an der Herstellung von Trypsin und Chymotrypsin unter Verwendung der rekombinanten DNA -Technologie durch die Verwendung verschiedener Bakterien- und Pilzarten beteiligt, da diese Enzyme einen hohen Industriewert besitzen. Dies ist der Unterschied zwischen Trypsin und Chymotrypsin.
Laden Sie die PDF -Version von Trypsin vs Chymotrypsin herunter
Sie können die PDF -Version dieses Artikels herunterladen und ihn für Offline -Zwecke gemäß Citation Note verwenden. Bitte laden Sie die PDF -Version hier den Unterschied zwischen Trypsin und Chymotrypsin herunter
Referenz:
1.„Chymotrypsin.”Chymotrypsin - Worthington Enzymhandbuch. Hier verfügbar
2.„Trypsin.Trypsin - Worthington Enzymhandbuch. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Serin Protease'by Tinastella bei English Wikibooks (Public Domain) über Commons Wikimedia
2.'Chymotrypsin 4cha'by Yikrazuul - eigene Arbeit, (CC BY -SA 3.0) über Commons Wikimedia


