Unterschied zwischen unimolekularen und bimolekularen Reaktionen
Schlüsselunterschied - unimolekular gegen bimolekulare Reaktionen
In der Chemie wird der Begriff Molekularität verwendet, um die Anzahl der Moleküle auszudrücken, die zusammenkommen, um in einer elementaren Reaktion zu reagieren. Eine elementare Reaktion ist eine einzelne Stufenreaktion, die das Endprodukt direkt nach der Reaktion zwischen den Reaktanten ergibt. Dies bedeutet, dass die Elementarreaktionen chemische Reaktionen sind, die vor der Bildung des Endprodukts keine Zwischenschritte haben. Unimolekulare und bimolekulare Reaktionen sind solche Elementarreaktionen. Der Schlüsselunterschied Zwischen unimolekularen und bimolekularen Reaktionen befindet sich das Unimolekulare Reaktionen betreffen nur ein Molekül als Reaktant.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind unimolekulare Reaktionen
3. Was sind bimolekulare Reaktionen
4. Ähnlichkeiten zwischen unimolekularen und bimolekularen Reaktionen
5. Seite für Seitenvergleich - unimolekulare gegen bimolekulare Reaktionen in tabellarischer Form
6. Zusammenfassung
Was sind unimolekulare Reaktionen?
Unimolekulare Reaktionen sind Elementarreaktionen, die nur ein Molekül als Reaktant umfassen. Dort ist die Reaktion eine Umlagerungsreaktion. Das einzelne Molekül ordnet sich um, um mehr unterschiedliche Moleküle als Endprodukte zu bilden. Dies geschieht jedoch in einem einzigen Schritt. Es gibt keine Zwischenschritte, die das Reaktantmolekül in der Bildung des Endprodukts unterzogen. Es gibt direkt die Endprodukte. Die Gleichung für die Reaktion kann als angegeben werden
A → p
Hier ist A Reaktant und P ist das Produkt. Nach der ersten Ordnung des Geschwindigkeitsgesetzes kann die Reaktionsgeschwindigkeit wie unten angegeben werden.
Rate = k [Reaktant]
Einige Beispiele für unimolekulare Reaktionen sind die Followings:
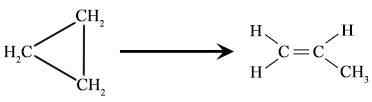
Abbildung 01: Cyclopropan -Umlagerung zur Bildung von Propan.
- Umwandlung von n2Ö4 in zwei nein2 Moleküle
- Umwandlung von Cyclopropan in Propene
- Umwandlung von PCL5 in PCL3 und Cl2
Was sind bimolekulare Reaktionen?
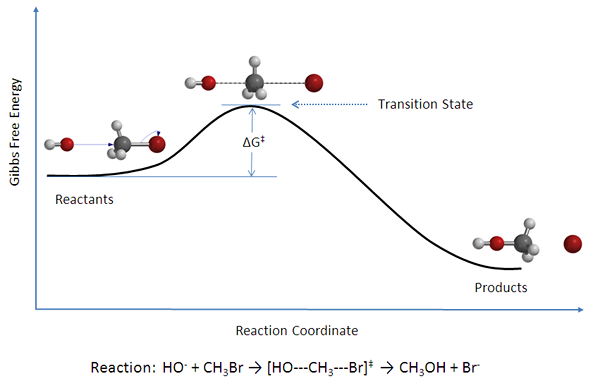
Bimolekulare Reaktionen sind elementare chemische Reaktionen, die zwei Moleküle als Reaktanten betreffen. Es kann als Kollision von zwei Molekülen oder Partikeln beschrieben werden. Dies sind häufige chemische Reaktionen in der organischen und anorganischen Chemie. Die beiden Moleküle können von den gleichen oder verschiedenen Typen sein. Zum Beispiel können die beiden Moleküle zwei Nocl -Moleküle mit derselben Atomanordnung sein oder C und O sein2 unterschiedliche atomare Kombinationen haben. Die Gleichungen für die bimolekularen Reaktionen sind wie unten angegeben.
A +a → p
A +b → p

Abbildung 02: Energiediagramm für eine bimolekulare Reaktion.
Da es zwei Reaktanten gibt, werden diese Reaktionen als Reaktionen zweiter Ordnung erklärt. Daher werden diese bimolekularen Reaktionen nach dem Gesetz der zweiten Ordnung beschrieben;
Rate = [a]2
Oder
Rate = [a] [b]
In welcher Gesamtreihenfolge immer 2 beträgt. Einige Beispiele für bimolekulare Reaktionen sind unten angegeben.
- Reaktion zwischen CO und Nr3
- Reaktion zwischen zwei Nocl -Molekülen
- Reaktion zwischen CL und C4
Was sind die Ähnlichkeiten zwischen unimolekularen und bimolekularen Reaktionen?
- Sowohl unimolekulare als auch bimolekulare Reaktionen sind Elementarreaktionen.
- Sowohl unimolekulare als auch bimolekulare Reaktionen geben das Produkt in einem einzigen Schritt.
- Sowohl unimolekulare als auch bimolekulare Reaktionen haben keine Zwischenschritte.
Was ist der Unterschied zwischen unimolekularen und bimolekularen Reaktionen?
Unimolekulare gegen biomolekulare Reaktionen | |
| Unimolekulare Reaktionen sind Elementarreaktionen, die nur ein Molekül als Reaktant umfassen. | Bimolekulare Reaktionen sind elementare chemische Reaktionen, die zwei Moleküle als Reaktanten betreffen. |
| Reaktanten | |
| Unimolekulare Reaktionen haben einen Reaktanten | Bimolekulare Reaktionen haben zwei Reaktanten. |
| Bestellung des Ratengesetzes | |
| Unimolekulare Reaktionen werden durch Erste Ordnung des Ratenrechtes erläutert. | Bimolekulare Reaktionen werden durch das Ratengesetz zweiter Ordnung erklärt. |
| Gesamtreihenfolge | |
| Die Gesamtreihenfolge der Ratengleichung unimolekularer Reaktionen beträgt immer 1. | Die Gesamtreihenfolge der Geschwindigkeitsgleichung bimolekularer Reaktionen beträgt immer 2. |
Zusammenfassung -unimolekular gegen bimolekulare Reaktionen
Unimolekulare und bimolekulare Reaktionen sind Elementarreaktionen. Diese Reaktionen geben das Produkt in einem einzigen Schritt. Diese Reaktionen können auch unter Verwendung von Ratengesetzen ausgedrückt werden. Der Unterschied zwischen unimolekularen und bimolekularen Reaktionen besteht darin, dass unimolekulare Reaktionen nur einen Reaktanten betreffen.
Laden Sie den PDF von unimolekularen gegen bimolekularen Reaktionen herunter
Sie können die PDF -Version dieses Artikels herunterladen und sie für Offline -Zwecke gemäß Citation Note verwenden. Bitte laden Sie die PDF -Version hier herunter: Unterschied zwischen unimolekularen und bimolekularen Reaktionen
Referenz:
1.„Elementare Reaktionen.”Chemistry Libretexten, Libretexte, 26. Mai 2017. Hier verfügbar
2.„Elementare Reaktion.”Wikipedia, Wikimedia Foundation, 10. Februar. 2018. Hier verfügbar
3.„Molekularität.”Wikipedia, Wikimedia Foundation, 13. Februar. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Izomerisierung von Cyclopropane'By Djokili92 - eigene Arbeit, (CC BY -SA 4.0) über Commons Wikimedia
2.'RXN -Koordinatendiagramm 5'By Chem540grp1f08 - eigene Arbeit, (CC BY -SA 3.0) über Commons Wikimedia


