Unterschied zwischen Valenz und Oxidationszahl
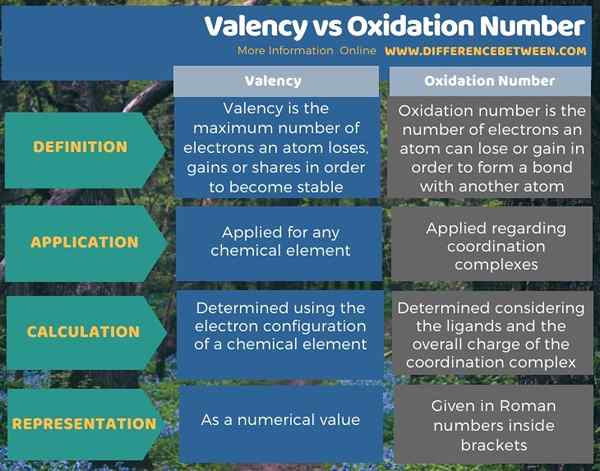
Der Schlüsselunterschied Zwischen der Valenz und der Oxidationszahl ist das Die Valenz ist die maximale Anzahl von Elektronen, die ein Atom verlieren, gewinnen oder stabil werden kann, während die Oxidationszahl die Anzahl der Elektronen ist, die ein Atom verlieren oder gewinnen kann, um eine Bindung mit einem anderen Atom zu bilden.
Die Begriffe Oxidationszahl und Valenz beziehen sich auf die Valenzelektronen eines Atoms. Valenzelektronen sind die Elektronen, die die äußersten Orbitale eines Atoms einnehmen. Diese Elektronen haben eine schwache Anziehungskraft auf den Atomkern; Daher können Atome diese Elektronen leicht entfernen oder mit anderen Atomen teilen. Dieser Verlust, diese Gewinn oder das Teilen von Elektronen bewirken ein bestimmtes Atom eine Oxidationszahl und Valenz, und schließlich bildet es eine chemische Bindung zwischen den beiden Atomen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Valenz?
3. Was ist Oxidationszahl
4. Seite für Seitenvergleich - Valenz gegen Oxidationszahl in tabellarischer Form
5. Zusammenfassung
Was ist Valenz??
Valenz ist die maximale Anzahl von Elektronen, die ein Atom verliert, Gewinne oder Aktien, um stabil zu werden. Für Metalle und Nichtmetalle beschreibt die Oktettregel die stabilste Form eines Atoms. Wenn die Anzahl der äußersten Hülle eines Atom. Mit anderen Worten, wenn die S- und P-Suborbitale vollständig gefüllt sind, haben NS2np6 Konfiguration ist das Atom stabil.
Natürlich haben Edelgasatome diese Elektronenkonfiguration. Daher müssen andere Elemente Elektronen entweder verlieren, gewinnen oder teilen, um der Oktettregel zu befolgen. Die maximale Anzahl von Elektronen, die ein Atom verlieren oder an dieser Stabilisierung zu gewinnen oder zu teilen, ist die Wertigkeit dieses Atoms.
Betrachten wir zum Beispiel Silizium. Die Elektronenkonfiguration von Silizium beträgt 1s22s22p63s23p2. Die äußerste Schale ist n = 3 und hat 4 Elektronen. Daher sollte es vier weitere Elektronen erhalten, um das Oktett zu vervollständigen. Im Allgemeinen kann Silizium 4 Elektronen mit anderen Elementen teilen, um das Oktett zu vervollständigen. Somit beträgt die Valenz von Silizium 4.
Für verschiedene chemische Elemente unterscheidet sich die Valenz. Es liegt daran, dass Elektronen gemäß den Energieniveaus dieser Orbitale zu den Orbitalen gefüllt sind. Die meisten Übergangsmetalle haben jedoch die gleiche Valenz; Oft ist es 2. Einige Elemente können jedoch Differenzalenzen aufweisen, da das Atom in verschiedenen Elektronenkonfigurationen durch Entfernen von Elektronen stabilisiert werden kann.
Zum Beispiel ist die Elektronenkonfiguration in Eisen (Fe) [AR] 3D64s2. Daher beträgt die Eisenvalenz 2 (2 Elektronen in 4s2). Aber manchmal wird die Eisenvalenz zu 3. Es ist, weil der 3D5 Die Elektronenkonfiguration ist stabiler als 3D6. Das Entfernen eines weiteren Elektrons zusammen mit 4S -Elektronen stabilisiert Eisen mehr mehr.
Was ist Oxidationszahl?
Die Oxidationszahl ist die Anzahl der Elektronen, die ein Atom verlieren oder zu gewinnen kann, um eine Bindung zu einem anderen Atom zu bilden. Manchmal verwenden wir die Begriffe Oxidationszustand und Oxidationszahl austauschbar, aber sie haben geringfügige Unterschiede.
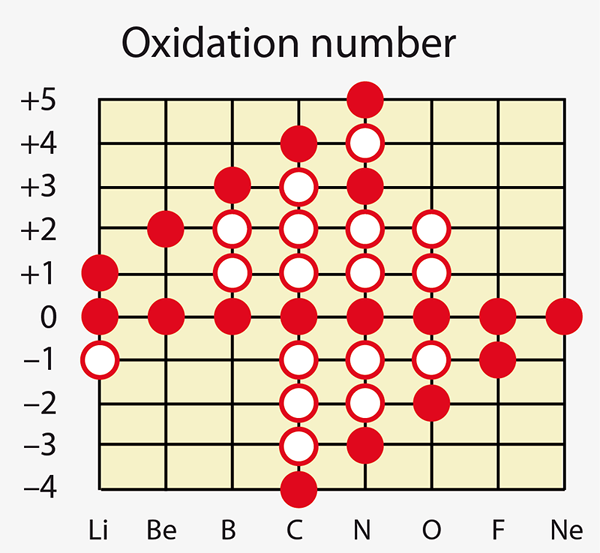
Abbildung 01: Einige chemische Elemente können unterschiedliche Oxidationszahlen zeigen
In den meisten Fällen wird der Begriff Oxidationsnummer für Koordinationskomplexe angewendet. In Koordinationskomplexen ist die Oxidationszahl die Ladung des zentralen Atoms einer Koordinationsverbindung, wenn alle Bindungen um dieses Atom ionische Bindungen waren. Koordinationskomplexe bestehen fast immer aus Übergangsmetallatomen in der Mitte des Komplexes. Dieses Metallatom hat chemische Gruppen in seiner Umgebung, die wir als Liganden bezeichnen. Diese Liganden haben einzelne Elektronenpaare, die mit Metallatomen geteilt werden können, um Koordinationsbindungen zu bilden.
Nach der Bildung der Koordinationsbindung ähnelt sie einer kovalenten Bindung. Es liegt daran, dass die beiden Atome in den Koordinierungsbindungen ein Paar Elektronen haben. Wir müssen jedoch die Oxidationszahl des zentralen Metallatoms unter Berücksichtigung der Koordinationsbindungen als ionische Bindungen berechnen.
Was ist der Unterschied zwischen Valenz und Oxidationszahl?
Die Begriffe Oxidationszahl und Valenz beziehen sich auf die Valenzelektronen eines Atoms. Der wichtigste Unterschied zwischen Valenz und Oxidationszahl besteht darin, dass die Valenz die maximale Anzahl von Elektronen ist, die ein Atom verlieren, gewinnen oder stabil werden kann, während die Oxidationszahl die Anzahl der Elektronen ist, die ein Atom verlieren kann oder um eine Bindung mit einem anderen Atom zu bilden kann. Darüber hinaus wird der Begriff Valenz für jedes chemische Element angewendet, aber der Begriff Oxidationsnummer wird hauptsächlich in Bezug auf Koordinierungskomplexe angewendet.
Die folgende Infografik fasst den Unterschied zwischen Valenz und Oxidationszahl zusammen.

Zusammenfassung -Valenz gegen Oxidationszahl
Sowohl die Oxidationszahl als auch die Valenz sind Begriffe im Zusammenhang mit den Valenzelektronen eines Atoms. Der wichtigste Unterschied zwischen Valenz und Oxidationszahl besteht darin, dass die Valenz die maximale Anzahl von Elektronen ist, die ein Atom verlieren, gewinnen oder stabil werden kann, während die Oxidationszahl die Anzahl der Elektronen ist, die ein Atom verlieren kann oder um eine Bindung mit einem anderen Atom zu bilden kann.
Referenz:
1. "Oxidationszahl.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., Hier verfügbar.
Bild mit freundlicher Genehmigung:
1. "Periode 2 Oxidationszahlen" von Albris - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia


