Unterschied zwischen Xylol und Aceton
Der Schlüsselunterschied Zwischen Xylol und Aceton ist das Xylol ist ein billiges und weniger giftiges Lösungsmittel, während Aceton ein teureres und giftigeres Lösungsmittel ist.
Sowohl Xylol als auch Aceton sind als Lösungsmittel in Chemielabors wichtig. Es sind jedoch zwei verschiedene Verbindungen, und ihre Eigenschaften unterscheiden sich auch stark voneinander.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Xylol
3. Was ist Aceton
4. Seite an Seitenvergleich - Xylol gegen Aceton in tabellarischer Form
5. Zusammenfassung
Was ist Xylol?
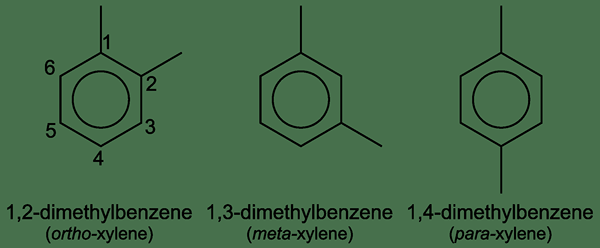
Xylol ist eine organische Verbindung mit der chemischen Formel (CH3)2C6H4. Wir können es als Dimethylbenzol bezeichnen, da es ein Benzol mit zwei angebrachten Methylgruppen hat. Ferner tritt diese Verbindung in einem von drei Isomeren auf, deren Positionen von Methylgruppen am Benzolring voneinander unterscheiden. Alle diese drei Isomere treten als farblose, brennbare Flüssigkeiten auf; Genauer gesagt wird eine Mischung dieser Isomere als „Xyllene“ bezeichnet.

Abbildung 01: Isomere von Xylol
Wir können diese Verbindung durch katalytische Reformierung während der Raffination von Erdöl oder durch Kohlekarbonisierung während der Herstellung von Koksbrennstoffen produzieren. In der Industrie erfolgt die Xylolproduktion jedoch durch Methylierung von Toluol und Benzol.
Xylol ist ein unpolares Lösungsmittel. Es ist jedoch teuer und vergleichsweise giftig. Die unpolare Natur ist auf den geringen Unterschied der Elektronegativität zwischen C und H zurückzuführen. Daher neigt Xylol dazu, lipophile Substanzen gut aufzulösen.
Was ist Aceton?
Aceton ist eine organische Verbindung mit der chemischen Formel (CH3)2CO. Es tritt als farblose und brennbare Flüssigkeit auf, die sehr flüchtig ist. Es ist das einfachste und kleinste Keton. Die Molmasse beträgt 58.08 g/mol. Es hat einen scharfen, irritierenden Geruch, aber wir können ihn als einen blumigen, gurkenähnlichen Geruch definieren. Es ist mit Wasser mischbar. Außerdem ist diese Verbindung als polares Lösungsmittel üblich. Die Polarität ist auf den Unterschied mit hoher Elektronegativität zwischen Kohlenstoff- und Sauerstoffatomen der Carbonylgruppe zurückzuführen. Es ist jedoch nicht so viel polar. Somit kann es sowohl lipophile als auch hydrophile Substanzen auflösen.
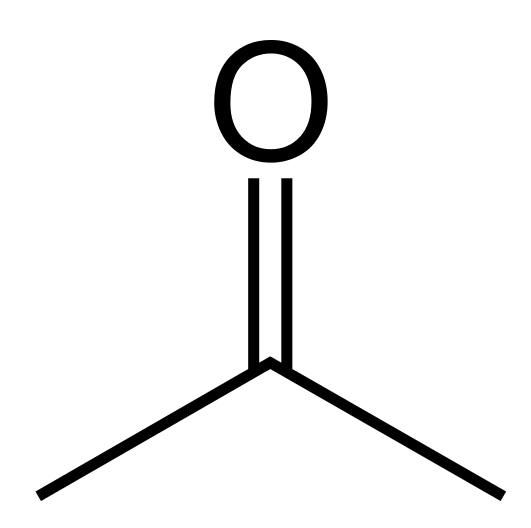
Abbildung 02: Chemische Struktur von Aceton
Unser Körper kann Aceton in normalen Stoffwechselprozessen produzieren und es auch durch verschiedene Mechanismen aus dem Körper entsorgt. In einer industriellen Skala umfasst die Produktionsmethode die direkte oder indirekte Produktion aus Propylen. Der gemeinsame Prozess ist der CUMENE -Prozess.
Was ist der Unterschied zwischen Xylol und Aceton?
Xylol ist eine organische Verbindung mit der chemischen Formel (CH3)2C6H4 Während Aceton eine organische Verbindung mit der chemischen Formel ist (CH3)2CO. Der Hauptunterschied zwischen Xylol und Aceton besteht darin. Darüber hinaus ist Xylol unpolar und Aceton ist weniger polar; Daher kann Xylol lipophile Substanzen auflösen, aber Aceton kann sowohl lipophile als auch hydrophile Substanzen auflösen.
Die folgende Infografik fasst den Unterschied zwischen Xylol und Aceton zusammen.
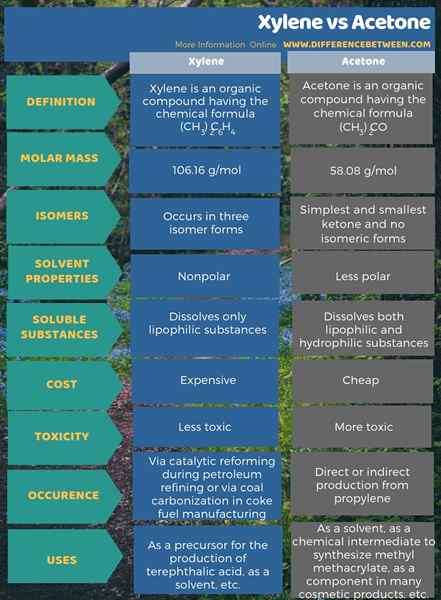
Zusammenfassung -Xylol gegen Aceton
Xylol ist eine organische Verbindung mit der chemischen Formel (CH3)2C6H4 Während Aceton eine organische Verbindung mit der chemischen Formel ist (CH3)2CO. Der Hauptunterschied zwischen Xylol und Aceton besteht darin.
Bild mit freundlicher Genehmigung:
1. "IUPAC-Cyclic" von Fvasconcellos 20:19, 8. Januar 2008 (UTC). Originalbild von DRBOB (Talk · Beiträge). - Vektorversion von Bild: IUPAC-Cyclic.PNG von DRBOB (talk · Beiträge) (CC BY-SA 3.0) über Commons Wikimedia
2. "Acetone-2D-Skelettal" von FVasconcellos-Vektorversion der Datei: Acetone-2D-Skelettal.PNG von Ben Mills (Public Domain) über Commons Wikimedia


