Was ist der Unterschied zwischen Arsen 3 und Arsen 5
Der Schlüsselunterschied zwischen Arsen 3 und Arsen 5 ist, dass Arsen 3 oder Arsenit giftiger als Arsen 5 oder Arsenat ist.
Arsen wird oft als giftiges chemisches Element angesehen. Es kann in verschiedenen Verbindungen gefunden werden, insbesondere in Mineralien. Arsen 3 oder Arsenit ist eine chemische Spezies, die aus einem Arsen -Oxyanion besteht, in dem der Oxidationszustand von Arsen +3 beträgt. Arsener 5 oder Arsenat ist eine chemische Verbindung mit Arsen-5-Oxyanion mit Arsen-5.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Arsen 3 (Arsenit)
3. Was ist Arsen 5 (Arsenat)
4. Arsen 3 gegen Arsen 5 in tabellarischer Form
5. Zusammenfassung -Arsenic 3 gegen Arsenic 5
Was ist Arsen 3 (Arsenit)?
Arsen 3 oder Arsenit ist eine chemische Spezies, die aus einem Arsen -Oxyanion besteht, in dem der Oxidationszustand von Arsen +3 beträgt. Das Feld der Grundwasserchemie verwendet Arsenit als Hinweis auf die Präsenz von Arsen 3 im Grundwasser. Laut IUPAC -Guides werden Arsenitverbindungen Arsenate genannt (III), e.G. Ortho-Arsenit wird als Trioxidoarsenat bezeichnet (III). Ortho-Arsenit enthält entsprechende Anionen der leichteren Mitglieder der Gruppe 15 wie Phosphit und Nitrit.
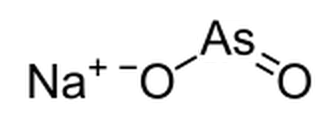
Abbildung 01: Die chemische Struktur von Natriumsalz aus Arsenit
Wir können einige Arsenitalze aus der wässrigen Lösung von AS herstellen2Ö3. Zum Beispiel Meta-Arsenit-Salze, Wasserstoffarsenitsalze usw. Darüber hinaus gibt es viele verschiedene Mineralien, die aus Arsen 3 bestehen, wie Reinerite, Finnemanite, Paulmoorite und Stenhuggarite.
Es gibt einige wichtige Verwendungen von Arsen 3, wie beispielsweise die Verwendung bei Wassergasverschiebungsreaktionen bei der Entfernung von Kohlendioxid. Darüber hinaus können einige Bakterienspezies Energie erhalten, indem sie verschiedene Kraftstoffe oxidieren und gleichzeitig Arsenate bei der Bildung von Arseniten reduzieren. Dieser Prozess ist an einigen Reaktionen beteiligt, die Enzyme enthalten, die als Arsenatreduktasen bekannt sind.
Was ist Arsen 5 (Arsenat)?
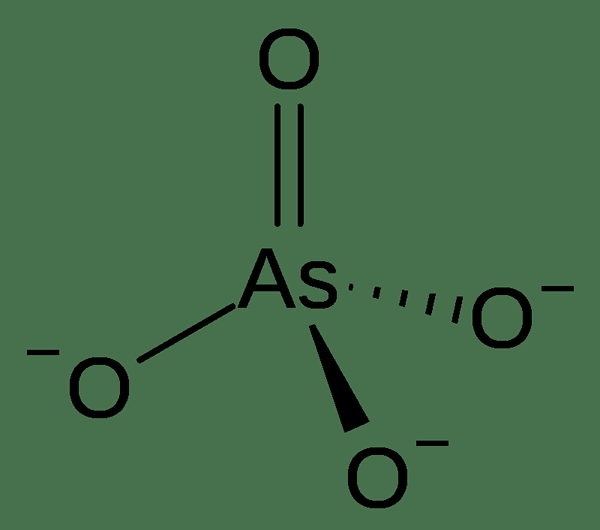
Arsen 5 oder Arsenat ist eine chemische Verbindung mit Arsen-5 Oxyanion mit Arsen-5. Das Arsenatanion hat ein Arsenatom im +5 Oxidationszustand. Es ist auch als Pentavalent -Arsen oder als (v) bekannt. Darüber hinaus ähnelt Arsenat in vielen Aspekten Phosphat. Arsenic-5-Verbindungen sind mäßige Oxidationsmittel mit einem Elektrodenpotential von +0.56 V für die Reduzierung von Arseniten.

Abbildung 02: Arsenic-5 Oxyanion
Natürlich tritt Arsen 5 in Mineralien auf, die aus hydratisierten oder wasserfreien Arsenaten bestehen. Anders als Phosphate verlaufen Arsenate während des Verwitterungsprozesses nicht von einem Mineral. Zum Beispiel Adamit, Alarsit, Annabergit, Erythrit usw., Arsen enthält 5.
Im Prozess der Arsenvergiftung kann Arsenat anorganisches Phosphat im Glykolysezyklus ersetzen, der 1-Arseno-3-Phosphoglycerat ergibt. Diese Verbindung ist instabil und hydrolysiert schnell, um das nächste Zwischenprodukt auf demselben Weg zu bilden. Dadurch wird die Glykolyse fortgesetzt, aber ein ATP -Molekül wird nicht erzeugt. Dies erklärt die Toxizität von Arsen 5.
Was ist der Unterschied zwischen Arsen 3 und Arsen 5?
Arsen ist ein wichtiges chemisches Element, das oft als toxisch angesehen wird. Arsen 3 oder Arsenit ist eine chemische Spezies, die aus einem Arsen -Oxyanion besteht, in dem der Oxidationszustand von Arsen +3 beträgt. Arsener 5 oder Arsenat ist eine chemische Verbindung mit Arsen-5-Oxyanion mit Arsen-5. Die häufigsten Oxidationszustände von Arsen sind +3 und +5 Oxidationszustände. Darüber hinaus besteht der Hauptunterschied zwischen Arsen 3 und Arsen 5 darin, dass Arsen 3 oder Arsenit toxischer ist als Arsen 5 oder Arsenat.
Die folgende Infografik zeigt die Unterschiede zwischen Arsen 3 und Arsen 5 in tabellarischer Form für den Nebenseitigen Vergleich.
Zusammenfassung -Arsenic 3 gegen Arsenic 5
Arsen 3 oder Arsenit ist eine chemische Spezies, die aus einem Arsen -Oxyanion besteht, in dem der Oxidationszustand von Arsen +3 beträgt. Arsener 5 oder Arsenat ist eine chemische Verbindung mit Arsen-5-Oxyanion mit Arsen-5. Der Hauptunterschied zwischen Arsen 3 und Arsen 5 besteht darin, dass Arsen 3 giftiger als Arsen 5 ist.
Referenz:
1. "Arsen.”Wikipedia. Wikipedia Foundation.
2. „Arsen (3+).Pubchem. NIH -National Library of Medicine, Nationales Zentrum für Biotechnologieinformationen.
Bild mit freundlicher Genehmigung:
1. "Natriummeta-Arsenit" von Claudio Pistilli-Travail-Personal (CC BY-SA 4.0) über Commons Wikimedia
2. "Arsenate Ion" von Ed (Edgar181) - eigene Arbeit (Public Domain) über Commons Wikimedia


