Was ist der Unterschied zwischen Aspartyl -Cystein und Serinproteasen
Der Schlüsselunterschied zwischen Aspartylcystein und Serinproteasen sind ihre funktionellen Gruppen, die als katalytische Rückstände wirken. Die funktionelle Gruppe, die als katalytische Reste von Aspartylprotease fungiert als funktionelle Gruppe am katalytischen Rückstand.
Proteasen sind Enzyme, die die Proteolyse katalysieren, nämlich den Abbau von Proteinen in kleinere Polypeptide oder Aminosäuren. Dieser Prozess erfolgt durch Spalten von Peptidbindungen in Proteinen durch einen Hydrolyseprozess. Proteasen sind an vielen biologischen Funktionen beteiligt, wie die Verdauung von aufgenommenen Proteinen, den Katabolismus von Proteinen und die Zellsignalisierung. Proteasen sind in allen Lebensformen vorhanden. Aspartyl, Cystein und Serin sind drei wichtige Proteasen, die eine Schlüsselrolle bei lebenden Organismen spielen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Aspartylproteasen
3. Was sind Cysteinproteasen
4. Was sind Serinproteasen
5. Ähnlichkeiten - Aspartylcystein- und Serinproteasen
6. Aspartyl gegen Cystein gegen Serinproteasen in tabellarischer Form
7. Zusammenfassung -aspartyl gegen Cystein gegen Serinproteasen
Was sind Aspartylproteasen?
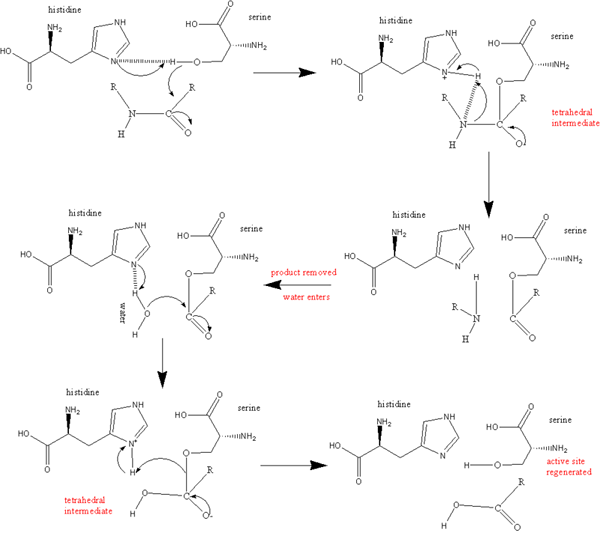
Aspartylproteasen sind eine Art von Protein-sprechenden Enzymen. Sie haben zwei hoch konservierte Aspartate im aktiven Zentrum und sind bei saurem pH -Wert optimal aktiv. Diese Proteasen spalten Dipeptidbindungen mit hydrophoben Resten sowie einer Beta-Methylen-Gruppe. Der katalytische Mechanismus der Aspartylprotease ist ein Säure-Base-Mechanismus. Dies beinhaltet die Koordination eines Wassermoleküls mit zwei Aspartatresten. Ein Aspartat aktiviert das Wassermolekül durch Entfernen eines Protons. Dies ermöglicht es dem Wasser, einen nukleophilen Angriff auf den Carbonylkohlenstoff des Substrats durchzuführen. Infolgedessen erzeugt es ein tetraedrisches Oxyanion -Zwischenprodukt, das durch Wasserstoffbrückenbindungen mit dem zweiten Aspartatrest stabilisiert wird. Die Umlagerung dieses Zwischenprodukts ist für die Aufteilung des Peptids in zwei Peptidprodukte verantwortlich.
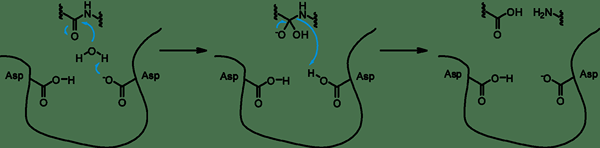
Abbildung 01: Aspartylprotease
Es gibt fünf Superfamilien von Aspartic Proteasen ist eine Omptin -Familie.
Was sind Cysteinproteasen?
Cysteinproteasen sind eine Gruppe von Hydrolase -Enzymen, die Proteine abbauen. Sie zeigen einen katalytischen Mechanismus, der ein nukleophiles Cystein -Thiol in einer katalytischen Triade oder Dyade beinhaltet. Der ursprüngliche Schritt im katalytischen Mechanismus von Cysteinproteasen ist die Deprotonierung. Die Thiol -Gruppe wird innerhalb des aktiven Zentrums des Enzyms durch eine benachbarte Aminosäure wie Histidin, die eine grundlegende Seitenkette hat, deprotoniert. Der nächste Schritt ist der nukleophile Angriff durch den deprotonierten anionischen Cysteinschwefel auf das Substrat. Hier freisetzt das Fragment des Substrats mit einem Amin, und der Histidinrest in der Protease stellt seine deprotonierte Form wieder her. Dies führt zur Bildung des Thioester -Intermediats des Substrats und verbindet den neuen Carboxy -Terminus mit dem Cystein Thiol. Die Thioester -Bindung hydrolysiert, um die Karbonsäure -Einheit auf dem verbleibenden Substratfragment zu erzeugen.
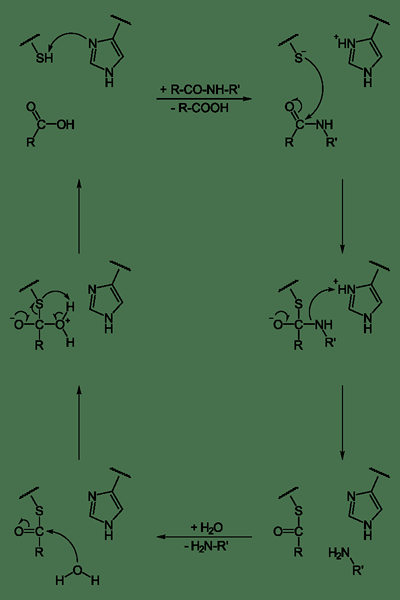
Abbildung 02: Cysteinprotease
Cysteinproteasen spielen in Physiologie und Entwicklung eine Vielzahl von Rollen. In Pflanzen spielen sie eine wichtige Rolle für das Wachstum, die Entwicklung, die Akkumulation und die Mobilisierung von Speicherproteinen. Beim Menschen sind sie wichtig für Seneszenz und Apoptose, Immunantworten, Prohormonverarbeitung und extrazelluläre Matrix -Umgestaltung zur Entwicklung der Kegelkegel.
Was sind Serinproteasen?
Serinproteasen sind auch eine Gruppe von proteolytischen Enzymen, die Peptidbindungen in Proteinen spalten. Serin dient als nucleophile Aminosäure am aktiven Zentrum des Enzyms. Diese sind sowohl in Eukaryoten als auch in Prokaryoten vorhanden. Serinproteasen werden normalerweise durch eine charakteristische Struktur in verschiedene Kategorien unterteilt, die aus zwei Beta-Barrel-Domänen besteht. Sie sind trypsinartig, chymotrypsinartig, thrombinartig, Elastase-ähnlich und subtilisinartig.

Abbildung 03: Serinprotease
Trypsinartige Proteasen spalten Peptidbindungen nach einer positiv geladenen Aminosäure wie Lysin oder Arginin. Sie sind spezifisch für negativ geladene Reste wie Asparaginsäure oder Glutaminsäure. Chymotrypsinähnliche Proteasen sind hydrophoberer. Ihre Spezifität liegt bei großen hydrophoben Resten wie Tyrosin, Tryptophan und Phenylalanin. Thrombinähnliche Proteasen umfassen Thrombin, ein Gewebe, das Plasminogen aktiviert, und Plasmin. Diese helfen bei der Koagulation von Blut und Verdauung sowie bei der Pathophysiologie bei neurodegenerativen Störungen. Elastase-ähnliche Proteasen bevorzugen Reste wie Alanin, Glycin und Valine. Subtilisinähnliche Proteasen umfassen Serin in Prokaryoten. Es teilt einen katalytischen Mechanismus mit einer katalytischen Triade, um ein nucleophiles Serin zu erzeugen. Die Regulation der Serinproteaseaktivität erfordert eine anfängliche Proteaseaktivierung und Sekretion von Inhibitoren.
Was sind die Ähnlichkeiten zwischen Aspartyl -Cystein und Serinproteasen?
- Aspartyl-, Cystein- und Serinproteasen katalysieren den Abbau von Proteinen durch Spaltung von Peptidbindungen.
- Die Mechanismen sind ähnlich, wenn die Reste der aktiven Zentrum die Peptidbindungen angreifen, wodurch sie brechen.
- Alle enthalten Nucleophile.
- Sie alle sind Proteine.
Was ist der Unterschied zwischen Aspartyl -Cystein und Serinproteasen?
Der Schlüsselunterschied zwischen Aspartyl -Cystein und Serinproteasen hängt von ihrer funktionellen Gruppe ab, die als katalytische Reste fungiert. In Aspartylprotease fungiert eine Carboxsäuregruppe als funktionelle Gruppe, während in Cysteinprotease eine Thiol- oder Sulfhydrylgruppe als funktionelle Gruppe fungiert, und in Serinprotease wirkt eine Hydroxylgruppe oder als Alkohol als funktionelle Gruppe.
Aspartylproteasen haben ein Aspartat -aktiv. Der Überreste des aktiven Zentrums von Serinprotease ist eine Hydroxylgruppe. Dies ist daher auch ein weiterer Unterschied zwischen Aspartyl -Cystein und Serinproteasen. Im Gegensatz zu Serin- und Cysteinproteasen bilden Aspartylproteasen während des Spaltenprozesses kein kovalentes Intermediat. Daher tritt die Proteolyse in einem einzigen Schritt für Aspartylproteasen auf.
Die folgende Infografik zeigt die Unterschiede zwischen Aspartyl -Cystein und Serinproteasen in tabellarischer Form für Seite für Seitenvergleich.
Zusammenfassung -Aspartyl Cystein gegen Serinproteasen
Proteasen sind Enzyme, die den Abbau von Proteinen in kleinere Polypeptide oder Aminosäuren katalysieren. Der Schlüsselunterschied zwischen Aspartyl -Cystein und Serinproteasen ist die funktionelle Gruppe, die als katalytischer Rückstand wirkt. Eine Carboxylsäuregruppe fungiert als funktionelle Gruppe in Aspartylprotease, während eine Thiol- oder Sulfhydrylgruppe als funktionelle Gruppe bei Cysteinprotease fungiert. Eine Hydroxylgruppe oder ein Alkohol fungiert als funktionelle Gruppe in Serinprotease.
Referenz:
1. „Protease -Mechanismen.Scable, Nature News, Nature Publishing Group.
2. „Cysteinprotease.Science Direct.
3. „Serinprotease.Science Direct.
Bild mit freundlicher Genehmigung:
1. "Aspartylprotease-Mechanismus" von englischer Wikipedia User Roadnottaken (CC BY-SA 3.0) über Commons Wikimedia
2. "CysteinProtease -Reakionsmechanismus" von Neurotiker - eigene Arbeit (Public Domain) über Commons Wikimedia
3. "Serinprotease-Mechanismus von Snellios" von Snellios an der englischsprachigen Wikipedia (CC BY-SA 3.0) über Commons Wikimedia


