Was ist der Unterschied zwischen Avidin und Streptavidin
Der Schlüsselunterschied zwischen Avidin und Streptavidin ist, dass Avidin eine hohe Affinität und Spezifität für Biotin hat, aber vergleichsweise weniger Affinität als Streptavidin, da Streptavidin-Biotin einer der stärksten Komplexe mit einer nichtkovalenten Bindung ist.
Avidin ist eine Art von Protein, die sich in den Eildern von Vögeln, Reptilien und Amphibien bildet. Streptavidin ist eine Art Protein, der aus der Reinigung des Bakteriums hergestellt wird Streptomyces avidinii.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Avidin
3. Was ist Streptavidin
4. Avidin gegen Streptavidin in tabellarischer Form
5. Zusammenfassung -Avidin gegen Streptavidin
Was ist Avidin?
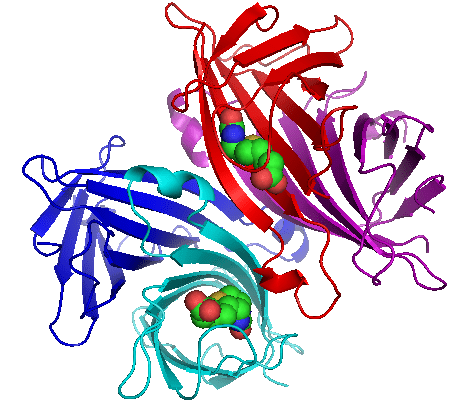
Avidin ist eine Art von Protein, die sich in den Eildern von Vögeln, Reptilien und Amphibien bildet. Dieses Protein ist ein tetramerisches Biotin-bindendes Protein, das in den Weißen von Eier abliedert. Neben tetrameren Formen gibt es dimere Mitglieder von Avidin. Wir können diese dimeren Formen in einigen Bakterien finden. Bei der Betrachtung von Hühnchen -Eiweiß hat es ungefähr 0.05% Avidin in Bezug auf den Gesamtproteingehalt.

Abbildung 01: Chemische Struktur und Erscheinung des Avidin -Moleküls
Es gibt vier identische Untereinheiten im tetrameren Protein. Deshalb können wir es als Homotetramer bezeichnen. Jedes Tetramer kann an Biotin binden (auch Vitamin B7 genannt). Die Affinität und Spezifität dieser Bindung ist sehr hoch. Der Avidin-Biotin-Komplex ist eine der stärksten bekannten nicht-kalvalenten Bindungen.
Wir können funktionelles Avidin in rohen Eier finden. Beim Kochen wird die Biotin -Affinität für Avidin zerstört. Die natürliche Funktion des Avidineis ist jedoch noch nicht genau bekannt. Wissenschaftler haben postuliert, dass sich dieses Protein im Eileit der Ei als Bakterienwachstumsinhibitor bildet. Es kann an Biotin binden (Biotin ist hilfreich für das Bakterienwachstum).
Darüber hinaus gibt es eine nicht glykosylierte Form von Avidin als kommerzielles Produkt. Es ist noch nicht bekannt, ob diese nicht-glykosylierte Form natürlich oder nicht auftritt. Es gibt einige wichtige Anwendungen dieses Proteins, einschließlich Forschungsanwendungen, biochemischen Assays, Reinigungsmedien usw.
Was ist Streptavidin?
Streptavidin ist eine Art Protein, der aus der Reinigung des Bakteriums hergestellt wird Streptomyces avidinii. Es ist ein Tetramer. Es gibt Homo-Tetramere von Streptavidin, die eine außerordentlich hohe Affinität zur Biotin haben. Es ist bekannt, dass die Bindung von Biotin an Streptavidin eine der stärksten nichtkovalenten Wechselwirkungen in der Natur ist. Dieses Protein ist nützlich in der molekularen Biologie und Bio-Nanotechnologie aufgrund der Resistenz des Streptavidin-Biotin-Komplexes gegenüber organischen Lösungsmitteln, Denaturanten, proteolytischen Enzymen, extremen Temperaturen, pH-Werten und Dengenzern.
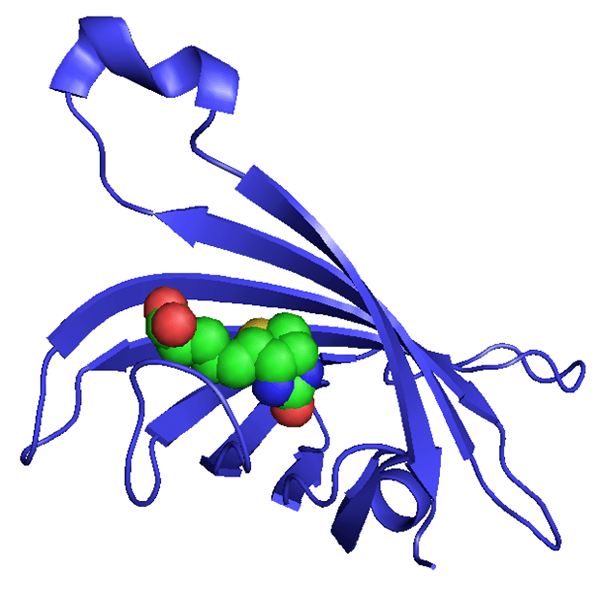
Abbildung 02: Struktur und Erscheinung des Streptavidin -Moleküls
Es gibt wichtige Anwendungen von Streptavidin wie Reinigung oder Nachweis verschiedener Biomoleküle, Reinigung und Nachweis genetisch veränderter Peptide, im Western Blotting, der Entwicklung von Nanobiotechnologie usw.
Was ist der Unterschied zwischen Avidin und Streptavidin?
Avidin ist eine Art von Protein, die sich in den Eildern von Vögeln, Reptilien und Amphibien bildet. Streptavidin ist eine Art Protein, der aus der Reinigung des Bakteriums hergestellt wird Streptomyces avidinii. Der Schlüsselunterschied zwischen Avidin und Streptavidin besteht darin, dass Avidin eine hohe Affinität und Spezifität für Biotin hat, aber vergleichsweise weniger Affinität als Streptavidin, da Streptavidin-Biotin einer der stärksten Komplexe mit einer nicht kalvalenten Bindung ist.
Die folgende Infografik zeigt die Unterschiede zwischen Avidin und Streptavidin in tabellarischer Form für Seite für Seitenvergleich.
Zusammenfassung -Avidin gegen Streptavidin
Avidin und Streptavidin sind wichtige Proteine. Der Schlüsselunterschied zwischen Avidin und Streptavidin besteht darin, dass Avidin eine hohe Affinität und Spezifität für Biotin hat, aber vergleichsweise weniger Affinität als Streptavidin, da Streptavidin-Biotin einer der stärksten Komplexe mit einer nicht kalvalenten Bindung ist.
Referenz:
1. „Biotinylierung.” Thermo Fisher Scientific - USA.
Bild mit freundlicher Genehmigung:
1. "Tetramer" von Oxford Grad bei English Wikipedia (CC BY-SA 3.0) über Commons Wikimedia
2. "Streptavidin" von Roo1812 (Bild), Weber, P.C., Ohlendorf, d.H., Wendoloski, j.J., Salemme, f.R. (Verwendete Daten) - eigene Arbeit unter Verwendung von PDB: 1STP (Public Domain) über Commons Wikimedia


