Was ist der Unterschied zwischen Bohr und Schrodinger -Modell
Der Schlüsselunterschied zwischen Bohr und Schrodinger Modell ist, dass im BOHR -Modell Elektronen Partikel sind, die nur bestimmte Umlaufbahnen mit fester Energie um den Kern einnehmen, während sich Elektronen im Schrodinger -Modell als stehende Wellen mit einer größeren Wahrscheinlichkeit verhalten, in einigen Bereichen des Weltraums im Vergleich zu anderen zu sein.
BOHR -Modell und Schrodinger -Modell sind sehr wichtige Modelle in der Chemie, da sie die chemische Struktur von Atomen und die Position von Elektronen zu einem bestimmten Zeitpunkt beschreiben.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist das Bohr -Modell
3. Was ist Schrodinger -Modell
4. Bohr gegen Schrodinger -Modell in tabellarischer Form
5. Zusammenfassung -BOHR vs Schrodinger Modell
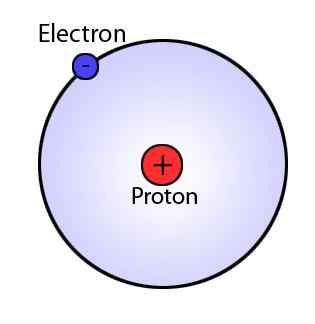
Was ist das Bohr -Modell?
Das Bohr -Modell, das eine Modifikation des Rutherford -Modells ist, erklärt die Struktur des Atoms, die aus einem Kern besteht, der von Elektronen umgeben ist. Das Bohr -Modell ist jedoch stark fortschrittlich als das Rutherford -Modell, da es darauf hindeutet. Dieses Modell besagt auch, dass diese Schalen unterschiedliche Energien haben und kugelförmige Form haben. Dieses Phänomen wurde durch Beobachtungen der Linienspektren für das Wasserstoffatom vorgeschlagen.
Da es in den Linienspektren diskrete Linien gibt.

Abbildung 01: BOHR -Modell
Haupt Postulate des Bohr -Modells
- Die Elektronen bewegen sich in kugelförmigen Orbitalen um den Kern, die eine feste Größe und Energie aufweisen.
- Jede Umlaufbahn hat einen anderen Radius und wird vom Kern nach außen als n = 1, 2, 3 usw. benannt., oder n = k, l, m usw., wobei n die Anzahl der festen Energienebene ist.
- Die Energie eines Orbitals hängt mit seiner Größe zusammen.
- Die kleinste Umlaufbahn hat die niedrigste Energie. Das Atom ist vollständig stabil, wenn die Elektronen auf dem niedrigsten Energieniveau liegen.
- Wenn sich ein Elektron in einem bestimmten Orbital bewegt, ist die Energie dieses Elektrons konstant.
- Elektronen können sich von einem Energieniveau zum anderen bewegen, indem sie Energie absorbieren oder freisetzen.
- Diese Bewegung verursacht Strahlung.
Im Allgemeinen passt das Bohrs Modell perfekt zum Wasserstoffatom, das ein einzelnes Elektron und einen kleinen positiv geladenen Kern aufweist. Abgesehen davon verwendete Bohr die Konstante von Plank, um die Energie der Energieniveaus des Atoms zu berechnen.
Es gab jedoch einige Nachteile des Bohr -Modells, wenn sie die Atomstruktur von anderen Atomen als Wasserstoff erklärte.
Einschränkungen des Bohr -Modells
- Das BOHR -Modell konnte den Zeeman -Effekt nicht erklären (Effekt des Magnetfeldes auf das Atomspektrum).
- Es konnte den starken Effekt nicht erklären (Effekt des elektrischen Feldes auf das Atomspektrum).
- Das Bohr -Modell erklärt die Atomspektren größerer Atome nicht.
Was ist Schrodinger -Modell?
Das Schrodinger -Modell ist ein Modell in der Chemie, das davon ausgeht, dass ein Elektron eine Welle ist. Dieses Modell beschreibt Regionen im Raum oder in Orbitalen als Orte, an denen Elektronen am wahrscheinlichsten auftreten. Dies ist ein mächtiges Modell des Atoms, das 1926 von Erwin Schrodinger entwickelt wurde. Er kombinierte die Gleichungen für das Verhalten von Wellen und die De Broglie -Gleichung, um ein mathematisches Modell zu erstellen, um die Verteilung von Elektronen in einem Atom zu beschreiben.

Abbildung 02: Wellenfunktion, wie von Schrodinger beschrieben
Der Hauptvorteil des Schrodinger -Modells besteht darin, dass es mathematische Gleichungen enthält, die als Wellenfunktionen bezeichnet werden, was die Notwendigkeit von Orten für das Verhalten von Elektronen erfüllen kann. Es kann jedoch schwierig sein, sich ein physikalisches Modell für Elektronen als Wellen vorzustellen. Anstatt zu versuchen zu sagen, wo sich das Elektron zu irgendeiner Zeit befindet.
Was ist der Unterschied zwischen Bohr und Schrodinger -Modell?
BOHR -Modell und Schrodinger -Modell sind wie die Grundlagen der allgemeinen Chemie. Der Hauptunterschied zwischen Bohr und Schrodinger -Modell besteht darin, dass im BOHR -Modell Elektronen Partikel sind, die nur bestimmte Umlaufbahnen mit fester Energie um den Kern einnehmen, während sich Elektronen im Schrodinger -Modell als stehende Wellen mit einer größeren Wahrscheinlichkeit verhalten, in einigen Raumbereiche im Vergleich zu anderen.
Im Folgenden finden Sie eine Zusammenfassung des Unterschieds zwischen Bohr- und Schrodinger -Modell in tabellarischer Form für Seite für Seitenvergleich.
Zusammenfassung -BOHR vs Schrodinger Modell
Sowohl das BOHR -Modell als auch das Schrodinger -Modell beschreiben die chemische Struktur von Atomen und die Position der Elektronen zu einem bestimmten Zeitpunkt. Der wichtigste Unterschied zwischen Bohr und Schrodinger -Modell besteht darin, dass im BOHR -Modell Elektronen Partikel sind, die nur bestimmte Umlaufbahnen mit fester Energie um den Kern einnehmen, während sich Elektronen im Schrodinger -Modell als stehende Wellen mit einer größeren Wahrscheinlichkeit verhalten, in einigen Raumbereiche im Vergleich zu anderen.
Referenz:
1. „Schrodinger -Modell.” Erwin Schrödinger, Purdue Education.
Bild mit freundlicher Genehmigung:
1. "Bohr -Modell" von JIA.Liu - eigene Arbeit (Public Domain) über Commons Wikimedia
2. "Wavepacket-A2K4-en" von Xcodexif-eigene Arbeit (CC BY-SA 4.0) über Commons Wikimedia


