Was ist der Unterschied zwischen Katalysator und Zwischenprodukt
Der Schlüsselunterschied zwischen Katalysator und Zwischenprodukt ist, dass ein Katalysator zu Beginn der Reaktion nützlich ist und am Ende regeneriert wird, während während der chemischen Reaktion ein Zwischenprodukt gebildet wird und am Ende der Reaktion nicht existiert.
Die Begriffe Katalysator und Zwischenprodukt sind bei chemischen Reaktionen sehr wichtig. Ein Katalysator ist eine chemische Verbindung, die die Rate einer Reaktion erhöhen kann, ohne sich selbst zu verbrauchen, während ein Zwischenprodukt ein Molekül ist, das sich aus zwei oder mehr Reaktanten bildet und eine weitere Reaktion unterliegt, um Endprodukte zu ergeben.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist ein Katalysator
3. Was ist ein Zwischenprodukt
4. Katalysator gegen Zwischenprodukt in tabellarischer Form
5. Zusammenfassung -Katalysator gegen Zwischenprodukt
Was ist ein Katalysator?
Ein Katalysator ist eine chemische Verbindung, die die Reaktionsgeschwindigkeit erhöhen kann, ohne sich selbst zu verzehren. Daher kann diese Verbindung immer wieder wiederholt handeln. Aus diesem Grund ist nur eine kleine Menge Katalysator für eine bestimmte chemische Reaktion erforderlich.
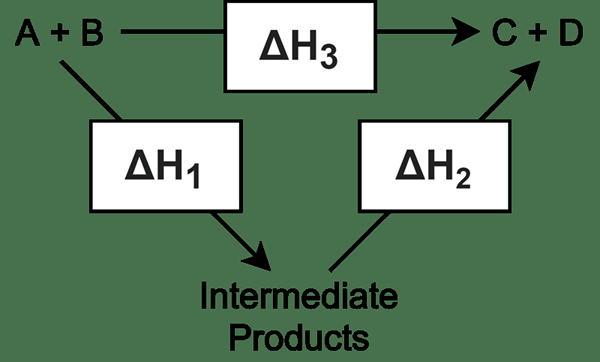
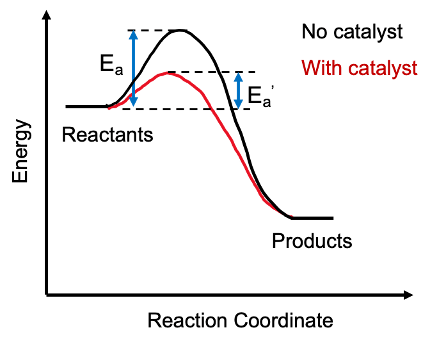
Ein Katalysator bietet einen alternativen Weg für eine chemische Reaktion, indem die Aktivierungsenergie einer Reaktion reduziert wird. Hier kombiniert sich der Katalysator mit dem Reaktanten, um ein Zwischenprodukt zu erstellen, und nach Abschluss der erforderlichen Reaktion verlässt der Katalysator das Zwischenprodukt und regeneriert sich regeneriert.
Es gibt zwei Arten von Katalysatoren; Sie sind homogene und heterogene Katalysatoren. In homogenen Katalysatoren befinden sich die Moleküle in der gleichen Phase wie Reaktantmoleküle. Bei heterogenen Katalysatoren befinden sich die Moleküle jedoch in einer anderen Phase der von Reaktantenmolekülen. Enzyme sind ein gutes Beispiel für biologische Katalysatoren.
Was ist ein Zwischenprodukt?
Ein Zwischenprodukt ist ein Molekül, das sich aus zwei oder mehr Reaktanten bildet und weitere Reaktionen erfährt, um endgültige Produkte zu liefern. Ein Zwischenprodukt wird in mehreren Schritten Reaktionen gebildet. Meistens erfordern komplizierte chemische Reaktionen mehr als einen Schritt, um die Reaktion abzuschließen, um das gewünschte Endprodukt zu erhalten. In diesen Reaktionen geben alle anderen Reaktionsschritte als den letzten Schritt Zwischenprodukte; Der letzte Schritt gibt dem Produkt an, anstatt ein Zwischenprodukt zu geben. Daher ist ein Zwischenprodukt instabil und neigt dazu, sich schnell weiter zu reagieren.

Typischerweise treten Zwischenprodukte im Reaktionsgemisch sehr selten aufgrund ihrer instabilen Natur auf. Sie existieren für kurze Zeit. Darüber hinaus ist es sehr schwierig, ein Zwischenprodukt zu isolieren, da es dazu neigt, weiter zu reagieren. In einer bestimmten Reaktion kann es in jedem Reaktionsschritt eine sehr hohe Anzahl von Zwischenmolekülen geben. Manchmal ist es sehr schwierig, diese Moleküle zu identifizieren.
Wir können zwischen Zwischenprodukten und molekularen Schwingungen unterscheiden. Diese haben typischerweise ähnliche Lebenszeiten und sind lediglich Übergänge. Normalerweise sind diese Moleküle hochreaktiv. Ein gutes Beispiel wäre die Veresterung eines Diols, bei dem im ersten Schritt ein Monoester produziert wird, und im zweiten (letzten) Schritt wird ein Dioester gebildet.
Was ist der Unterschied zwischen Katalysator und Zwischenprodukt?
Der Hauptunterschied zwischen Katalysator und Zwischenprodukt besteht darin. Darüber hinaus sind Katalysatoren stabil, während Zwischenprodukte sehr instabil sind.
Die folgende Infografik zeigt die Unterschiede zwischen Katalysator und Zwischenprodukt in tabellarischer Form für den Nebenseitigen Vergleich.
Zusammenfassung -Katalysator gegen Zwischenprodukt
Der Schlüsselunterschied zwischen Katalysator und Zwischenprodukt besteht darin, dass zu Beginn der Reaktion ein Katalysator zugegeben und am Ende der Reaktion regeneriert wird.
Referenz:
1. Helmenstine, Anne Marie, ph.D. „Was ist eine Reaktion mittelschwer??”Thoughtco, August. 27, 2020.
Bild mit freundlicher Genehmigung:
1. "Catalyst Energy Diagramm" von Emma Ambrogi - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia
2. "Hess Cycle Diagramm" von SGDWN - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia


