Was ist der Unterschied zwischen chemischer Kinetik und chemischem Gleichgewicht
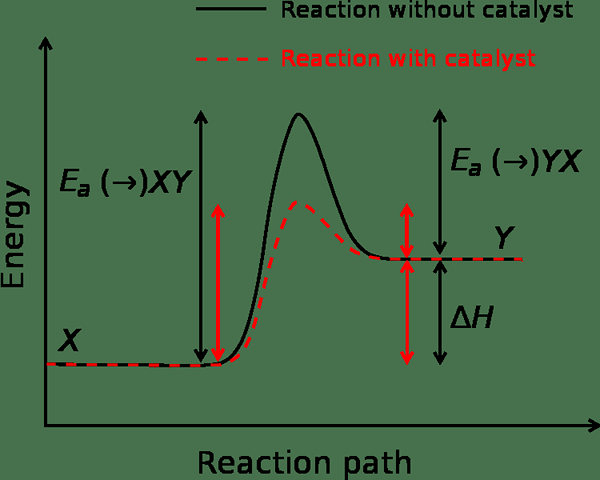
Der Schlüsselunterschied zwischen chemischer Kinetik und chemischem Gleichgewicht Ist die chemische Kinetik mit Reaktionsraten, während das chemische Gleichgewicht mit der unveränderlichen Natur der Konzentrationen von Reaktanten und Produkten im Laufe der Zeit befasst.
Chemische Kinetik ist der Zweig der physikalischen Chemie, der sich mit dem Verständnis der Raten chemischer Reaktionen befasst. Chemisches Gleichgewicht ist die Phase, in der sowohl Reaktanten als auch Produkte in Konzentrationen auftreten, die keine weitere Absicht haben, sich mit der Zeit zu ändern.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist chemische Kinetik
3. Was ist chemisches Gleichgewicht
4. Chemische Kinetik gegen chemisches Gleichgewicht in tabellarischer Form
5. Zusammenfassung - chemische Kinetik gegen chemisches Gleichgewicht
Was ist chemische Kinetik?
Chemische Kinetik kann als Zweig der physikalischen Chemie bezeichnet werden, der sich mit dem Verständnis der Raten chemischer Reaktionen befasst. Dieser Begriff wird im Gegensatz zur Thermodynamik diskutiert. Der Begriff Chemische Kinetik umfasst die Untersuchung experimenteller Bedingungen, die die Geschwindigkeit einer bestimmten chemischen Reaktion und Informationen zum Mechanismus der Reaktion sowie deren möglichen Übergangszustände beeinflussen können. Darüber hinaus befasst sich dieses Phänomen mit mathematischen Modellen, die die Eigenschaften einer Reaktion beschreiben.

Die Hauptfaktoren, die die chemische Kinetik beeinflussen.
Es gibt verschiedene Methoden zur Bestimmung der Reaktionsgeschwindigkeit einer bestimmten chemischen Reaktion. Hier müssen wir die Konzentration von Reaktanten oder Produkten messen, die sich im Laufe der Zeit ändern. E.G. Wir können die Konzentration eines Reaktanten durch Spektrophotometrie in Bezug auf eine Wellenlänge messen, bei der kein anderes Reaktant oder kein Produkt dieses Systems Licht absorbieren kann.
Was ist chemisches Gleichgewicht?
Chemisches Gleichgewicht ist die Phase, in der sowohl Reaktanten als auch Produkte in Konzentrationen auftreten, die keine weitere Absicht haben, sich mit der Zeit zu ändern. Es gibt reversible chemische Reaktionen sowie irreversible Reaktionen. Eine chemische Reaktion besteht darin, dass Reaktanten in Produkte umgewandelt werden. Manchmal werden Reaktanten aus den Produkten zurückgebracht. Dies sind reversible Reaktionen. Aber manchmal werden die Reaktanten während der gesamten Reaktion vollständig verbraucht und werden nicht wieder hergestellt. Dies sind irreversible Reaktionen. Bei einer reversiblen Reaktion nennen wir es, wenn Reaktanten in Produkte umgewandelt werden, eine Vorwärtsreaktion, und wenn die Produkte in Reaktanten umgewandelt werden, ist es eine Rückwärtsreaktion.
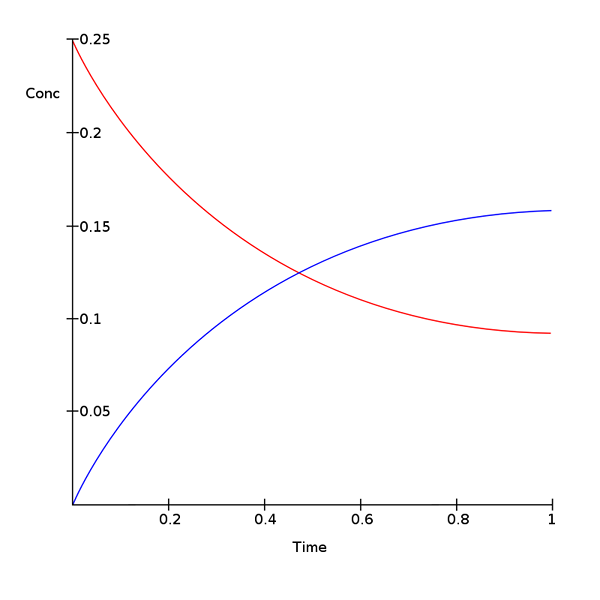
Wenn die Vorwärts- und Rückwärtsreaktionsgeschwindigkeiten gleich sind, befindet sich die Reaktion im Gleichgewicht. Daher ändert sich die Menge an Reaktanten und Produkten in einigen Zeiten nicht. Reversible Reaktionen neigen immer dazu, zum Gleichgewicht zu kommen und dieses Gleichgewicht zu behalten. Wenn sich das System im Gleichgewicht befindet, sind die Produktmenge und die Reaktanten nicht unbedingt gleich. Es kann eine höhere Menge an Reaktanten geben als Produkte oder umgekehrt. Die einzige Anforderung in einer Gleichgewichtsgleichung ist die Aufrechterhaltung einer konstanten Menge von beiden über die Zeit. Für eine Reaktion im Gleichgewicht können wir eine Gleichgewichtskonstante wie folgt definieren.
Was ist der Unterschied zwischen chemischer Kinetik und chemischem Gleichgewicht?
Die Begriffe chemischer Kinetik und chemisches Gleichgewicht sind in der Chemie sehr wichtig. Diese werden fast jeden Anlass in der Natur angewendet. Der Hauptunterschied zwischen chemischer Kinetik und chemischem Gleichgewicht besteht darin, dass die chemische Kinetik mit den Reaktionsraten umgeht, während das chemische Gleichgewicht mit der unveränderlichen Art der Konzentrationen von Reaktanten und Produkten im Laufe der Zeit befasst.
Die folgende Infografik zeigt die Unterschiede zwischen chemischer Kinetik und chemischem Gleichgewicht in tabellarischer Form für den Nebenseitigen Vergleich.
Zusammenfassung -chemische Kinetik gegen chemisches Gleichgewicht
Chemische Kinetik ist der Zweig der physikalischen Chemie, der sich mit dem Verständnis der Raten chemischer Reaktionen befasst. Chemisches Gleichgewicht ist die Phase, in der sowohl Reaktanten als auch Produkte in Konzentrationen auftreten, die keine weitere Absicht haben, sich mit der Zeit zu ändern. Der Hauptunterschied zwischen chemischer Kinetik und chemischem Gleichgewicht besteht darin, dass die chemische Kinetik mit den Reaktionsraten umgeht, während das chemische Gleichgewicht mit der unveränderlichen Art der Konzentrationen von Reaktanten und Produkten im Laufe der Zeit befasst.
Referenz:
1. "Chemisches Gleichgewicht.” Encyclopædia Britannica, Encyclopædia Britannica, Inc.
Bild mit freundlicher Genehmigung:
1. "Aktivierungsenergie" (urheberrechtlich geschützte freie Verwendung) über Commons Wikimedia
2. "Chemisches Gleichgewicht" von Fintelelia - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


