Was ist der Unterschied zwischen Enthalpie und molarem Enthalpie
Der Schlüsselunterschied zwischen Enthalpie und molarem Enthalpie ist, dass Enthalpie der Gesamtwärmegehalt eines thermodynamischen Systems ist, während die molare Enthalpie die Gesamtwärme pro Reaktantmol im System ist.
Enthalpie und molare Enthalpie sind nützliche Begriffe in der physikalischen Chemie zur Bestimmung des Gesamtwärmegehalts in einem thermodynamischen System. Wir können ein thermodynamisches System als eine Gruppe von Materie oder Strahlung definieren, die durch Wände mit bestimmten Permeabilitäten beschränkt ist, die dieses System von der Umgebung trennen können.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Enthalpie
3. Was ist molare Enthalpie
4. Enthalpie und molare Enthalpie in tabellarischer Form
5. Zusammenfassung - Enthalpie gegen molare Enthalpie
Was ist Enthalpie?
Die Enthalpie eines Systems ist eine thermodynamische Menge, die dem Gesamtwärmegehalt eines Systems entspricht. Es entspricht der inneren Energie des Systems sowie dem Produkt von Druck und Volumen. Daher ist es eine thermodynamische Eigenschaft eines Systems.
Die Gleichung von Enthalpie ist unten angegeben.
H = U +PV
In der obigen Gleichung ist H die Enthalpie des Systems, U ist die interne Energie des Systems, p der Druck und V ist das Volumen. Die Enthalpie eines Systems ist der Hinweis auf die Fähigkeit dieses Systems, Wärme freizusetzen (um nicht-mechanische Arbeiten zu erledigen). Die Enthalpie wird durch das Symbol h bezeichnet.

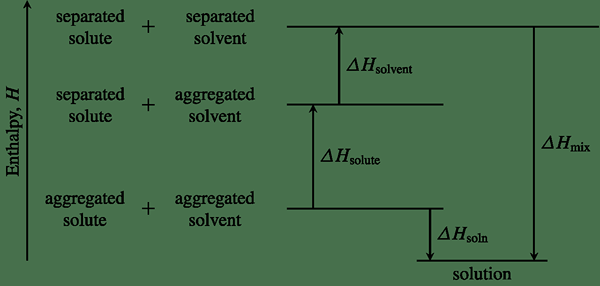
Abbildung 01: Ein Enthalpiediagramm, das die Enthalpieänderungen für eine bestimmte chemische Reaktion zeigt
Durch die Bestimmung der Enthalpie eines Systems können wir angeben, ob eine chemische Reaktion exotherm oder endotherm ist. Die Änderung der Enthalpie eines Systems kann verwendet werden, um die Reaktionswärme zu bestimmen und vorherzusagen, ob eine chemische Reaktion spontan oder nicht spontan ist.
Was ist molare Enthalpie?
Die molare Enthalpie ist der enthalpiewerte Wert pro Maulwurf. In dieser Definition ist Enthalpy eine thermodynamische Menge, die dem Gesamtwärmegehalt eines Systems entspricht. Es entspricht der inneren Energie des Systems sowie dem Produkt von Druck und Volumen. Die Messeinheit für diesen Wert ist kj/mol. Daher können wir die Gleichung zur Bestimmung der molaren Enthalpie wie folgt ableiten:
Molarenthalpy = dh/n
Wenn DH die Änderung der Enthalpie des Systems ist, ist „N“ die Anzahl der am System beteiligten Reaktantenmolen. Zum Beispiel ist die molare Enthalpie zur Bildung einer bestimmten Substanz die Änderung der Enthalpie, wenn ein Mol chemischer Spezies bei einer bestimmten Temperatur im Standardzustand gebildet wird. Diese Bildung der Substanz erfolgt aus der stabilsten Form der chemischen Elemente dieser Substanz in ihrem Standardzustand.
Was ist der Unterschied zwischen Enthalpie und molarem Enthalpie?
Enthalpie und molare Enthalpie sind nützliche Begriffe in der physikalischen Chemie zur Bestimmung des Gesamtwärmegehalts in einem thermodynamischen System. Der Schlüsselunterschied zwischen Enthalpie und molarem Enthalpie besteht darin. Darüber hinaus beträgt die Messeinheit für Enthalpie Joule oder Kilojoule, während die Messeinheit für molare Enthalpie Kilojoule pro Mole beträgt.
Die folgende Tabelle fasst den Unterschied zwischen Enthalpie und molarem Enthalpie zusammen.
Zusammenfassung -Enthalpie gegen molare Enthalpie
Enthalpie und molare Enthalpie sind nützliche Begriffe, die dazu beitragen, den Gesamtwärmegehalt in einem thermodynamischen System zu bestimmen. Die Enthalpie eines Systems ist eine thermodynamische Menge, die dem Gesamtwärmegehalt eines Systems entspricht. Die molare Enthalpie ist der enthalpiewerte Wert pro Maulwurf. Daher besteht der Hauptunterschied zwischen Enthalpie und molarem Enthalpie darin, dass Enthalpie der Gesamtwärmegehalt eines thermodynamischen Systems ist, während die molare Enthalpie die Gesamtwärme pro Reaktantmol im System ist.
Referenz:
1. „Molare Enthalpie.” Ein Überblick | Sciencedirect -Themen, .
2. „Was ist Enthalpie? - Definition, endotherme und exotherme Reaktion.”Byju, 16. November. 2020.
3. „Enthalpie.” Chemie -Libretexten, Libretexten, 15. August. 2020.
Bild mit freundlicher Genehmigung:
1. "Enthalpie-Diagrammlösungs-Formation-exotherm" von Dale J. Brugh - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia


