Was ist der Unterschied zwischen Zustandsgleichung und Aktivitätskoeffizient
Der Schlüsselunterschied zwischen Zustandsgleichung und Aktivitätskoeffizient ist, dass die Zustandsgleichung sowohl für Flüssigkeits- als auch für Gasphasen angewendet werden kann, während der Aktivitätskoeffizient nur für Gase angewendet wird.
Die Gleichung des Zustands- und Aktivitätskoeffizienten sind wichtige chemische Konzepte. Die Zustandsgleichung kann als thermodynamische Gleichung definiert werden, die sich auf Zustandsvariablen bezieht, die den Zustand der Materie unter bestimmten physikalischen Bedingungen beschreiben. Der Aktivitätskoeffizient ist ein Faktor, der für die Thermodynamik für die Bilanzierung von Abweichungen nützlich ist, die aus dem idealen Verhalten in einer Mischung chemischer Substanzen herrühren.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist die Zustandsgleichung
3. Was ist der Aktivitätskoeffizient
4. Zustandsgleichung gegen Aktivitätskoeffizient in tabellarischer Form
5. Zusammenfassung -Zustandsgleichung des Aktivitätskoeffizienten des Zustands gegen den Aktivität
Was ist die Zustandsgleichung?
Die Zustandsgleichung kann als thermodynamische Gleichung definiert werden, die mit den Zustandsvariablen zusammenhängt, die den Zustand der Materie unter bestimmten physikalischen Bedingungen beschreibt. Die angegebenen physikalischen Bedingungen umfassen Druck, Volumen, Temperatur und interne Energie. Diese Gleichung ist sehr wichtig, um die Eigenschaften von Flüssigkeiten, Flüssigkeitsmischungen, Feststoffen usw. zu erklären.
Es gibt keine Zustandsgleichungen, die die Eigenschaften aller Substanzen unter allen Bedingungen genau beschreiben. Daher beschreiben wir die Eigenschaften mit dem idealen Substanzenzustand. Zum Beispiel ist ein ideales Gasrecht eine Art Zustandsgleichung. Diese Gleichung ist bei schwachen polaren Gasen ungefähr genau, wenn niedrige Drücke und mäßige Temperaturen berücksichtigt werden.
Die allgemeine Form der Zustandsgleichung kann wie folgt angegeben werden:
f (p, v, t) = 0
Hier ist p absoluter Druck, V ist Volumen und T die absolute Temperatur ist. Klassisches ideales Gasgesetz, Quanten-Idealgasgesetz, kubische Zustandsgleichungen, nicht-kubische Zustandsgleichungen, Virial-Zustandsgleichungen, SAFT-Zustandsgleichungen, Multiparameter-Zustandsgleichungen usw., sind einige Arten von Zustandsgleichungen.
Was ist der Aktivitätskoeffizient?
Der Aktivitätskoeffizient ist ein Faktor, der in der Thermodynamik für die Bilanzierung von Abweichungen verwendet wird, die aus dem idealen Verhalten in einer Mischung chemischer Substanzen stammen. Bei der Betrachtung eines idealen Gemisches sind die mikroskopischen Wechselwirkungen zwischen Paaren chemischer Spezies normalerweise ähnlich. Daher können wir die Eigenschaften der Gemische direkt in Bezug auf einfache Konzentrationen oder teilweise Druck der vorhandenen Substanzen ausdrücken. Ein Beispiel dafür ist Raoultes Gesetz. Wir können die Abweichungen von der Idealität geben, indem wir die Konzentration mit einem Aktivitätskoeffizienten ändern. Das Gegenteil des Aktivitätskoeffizienten ist der Fugacity -Koeffizient.

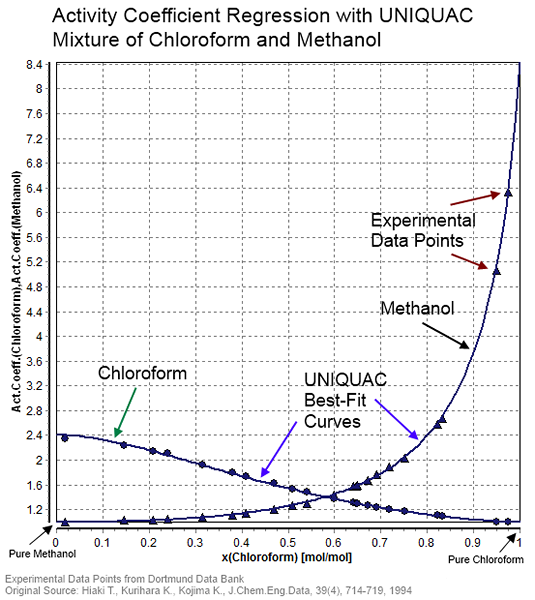
Abbildung 01: Aktivitätskoeffizient für ein Gemisch aus Chloroform und Methanol
Typischerweise können wir den Aktivitätskoeffizienten durch experimentelle Methoden bestimmen. Dies erfolgt durch Messungen an nicht idealen Gemischen. Die beiden Hauptmethoden sind die radiochemischen Methoden und die unendliche Verdünnungsmethode. Zum Beispiel. Wir können den Aktivitätskoeffizienten für binäre Gemische bei der unendlichen Verdünnung jeder Komponente erhalten.
Was ist der Unterschied zwischen Zustandsgleichung und Aktivitätskoeffizient?
Die Gleichung des Zustands- und Aktivitätskoeffizienten sind wichtige chemische Konzepte. Zustandsgleichung ist eine thermodynamische Gleichung, die sich auf die Zustandsvariablen bezieht, die den Zustand der Materie unter bestimmten physikalischen Bedingungen beschreibt, während der Aktivitätskoeffizient ein Faktor ist. Der Schlüsselunterschied zwischen Zustandsgleichung und Aktivitätskoeffizient besteht darin, dass die Zustandsgleichung sowohl für Flüssigkeits- als auch für Gasphasen angewendet werden kann, während der Aktivitätskoeffizient nur für Gase angewendet wird. Darüber hinaus kann die Zustandsgleichung kompliziert zu verwenden, während der Aktivitätskoeffizient vergleichsweise einfach zu verwenden ist.
Die folgende Infografik listet die Unterschiede zwischen Zustandsgleichung und Aktivitätskoeffizient in tabellarischer Form für Seite für Seitenvergleich auf.
Zusammenfassung -Zustandsgleichung des Aktivitätskoeffizienten des Zustands gegen den Aktivität
Die Gleichung des Zustands- und Aktivitätskoeffizienten sind wichtige chemische Konzepte. Der Schlüsselunterschied zwischen Zustandsgleichung und Aktivitätskoeffizient besteht darin, dass die Zustandsgleichung sowohl für Flüssigkeits- als auch für Gasphasen angewendet werden kann, während der Aktivitätskoeffizient nur für Gase angewendet wird.
Referenz:
1. "Staatsgleichung.” NASA.
Bild mit freundlicher Genehmigung:
1. "Uniquac Regression Chloroform Methanol" von WilfRiedC - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


