Was ist der Unterschied zwischen IgG IgM Iga IgE und IGD
Der Schlüsselunterschied Zwischen IgG IgM Iga IgE und IGD ist die Art der schweren Kette in jedem Antikörper. Während IgG eine γ -Art der schweren Kette hat, hat IgM eine μ schwere Kette Art. Im Gegensatz dazu hat IgA eine α -Art der schweren Kette, IgE ε der schweren Kette und IGD hat eine δ -Art der schweren Kette.
Die Antikörperproduktion findet als Reaktion auf ein Antigen als Teil der Aktivierung der adaptiven Immunmechanismen bei Tieren auf höherer Ebene statt. Die Antikörper-Antigen-Wechselwirkung aktiviert Reaktionen wie Agglutination, Neutralisierung, Opsonisierung, Komplementaktivierung und B-Zell-Aktivierung, die an der Erleichterung eines Immunantwortmechanismus gegen einen fremden Organismus teilnehmen. Antikörper variieren in ihren strukturellen und funktionellen Aspekten.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist IgG
3. Was ist IGM
4. Was ist IGA
5. Was ist Ige
6. Was ist IGD
7. Ähnlichkeiten -IgG IgM Iga IgE und IGD
8. IgG vs IgM gegen Iga gegen IGE gegen IGD in tabellarischer Form
9. Zusammenfassung -IgG vs IgM gegen Iga gegen IGE gegen IGD
Was ist IgG?
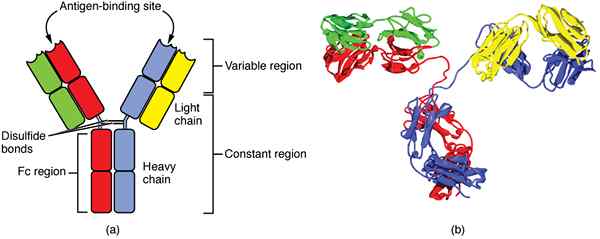
Immunglobulin oder IgG ist die häufigste Klasse von Immunglobulin, die in großen Mengen in Gewebeflüssigkeiten und Blut vorhanden ist. Es hat eine Serumkonzentration von über 75%. Das Molekulargewicht von IgG beträgt 150.000 d. IgG ist ein Monomer, und die schweren Ketten von IgG gehören zum γ -Typ.

Abbildung 01: 2D- und 3D -Strukturen von IgG
Es gibt zwei Antigenbindungsstellen. Die Unterklassen von IgG umfassen IgG1, IgG2, IgG3 und IgG4. IgG ist die einzige Art von Immunglobulin, die die Plazenta überqueren kann. IgG nimmt an der Induzierung des Immunschutzes seit der Säuglingsschaltung teil, da IgG auch während der Laktation von Mutter zu Baby weitergegeben wird. Die Schlüsselfunktion von IgG ist die Teilnahme an Opsonisierung und Neutralisationsimmunreaktionen. Es nimmt auch an der Aktivierung von Sekundärreaktionen während der Immunreaktionen teil.
Was ist IGM?
Immunglobulin m oder IgM hat eine einzigartige Pentamer -Struktur und ist somit die größte Art von Antikörper. Mit einem Molekulargewicht von etwa 900.000 T. macht es fast 10% des gesamten Antikörpers im Serum aus. Die einzigartige Pentamer-Struktur erleichtert 10 Antigenbindungsstellen. Die schweren IgM -Ketten bestehen aus dem μ -Typ. Es hat auch eine charakteristische Disulfidbindung, die jedes Monomer verbindet.
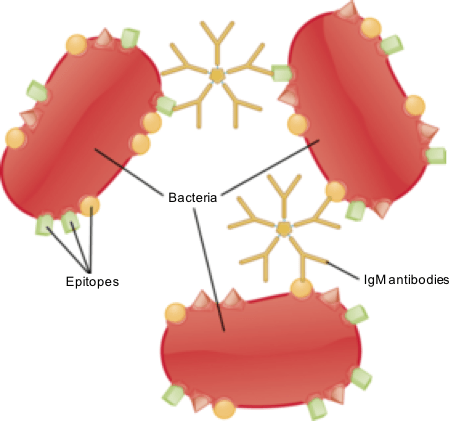
Abbildung 02: IgM -Aktivierung bei bakteriellen Infektionen
Die Hauptfunktion von IGM besteht darin, die primäre Immunantwort zu aktivieren. Es ist auch ein guter Aktivator des Komplementsystems und nimmt an Agglutination teil. Daher spielt IgM eine wichtige Rolle bei bakteriellen Infektionen.
Was ist IGA?
Immunglobulin A oder IgA ist ein dimerer Antikörper, der ein spezielles Element enthält, das als sekretorisches Element bezeichnet wird. Aufgrund seiner strukturellen Anordnung ist das Molekulargewicht mehr als das der Antikörperklassen mit monomeren Strukturen. Es ist 385.000.00 d. Es hat 4 Antigenbindungsstellen mit schweren Ketten, die aus dem α-Typ bestehen,. Es hat zwei Unterklassen: Iga1 und Iga2.
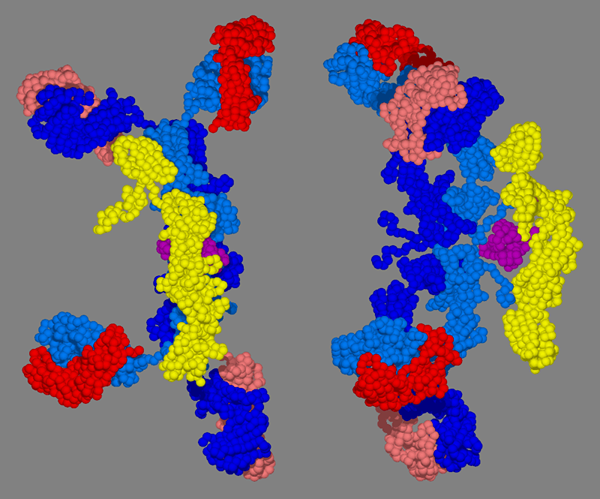
Abbildung 03: 3D -Struktur von IGA
Aufgrund seiner Fähigkeit, als sekretorisches Element zu fungieren. Darüber hinaus ist es auch im Kolostrum vorhanden. Etwa 15% des gesamten Serumantikörpers sind für die Klasse der IGA -Antikörper verantwortlich. IGA nimmt nicht an der Aktivierung des Komplementsystems teil. Seine Hauptfunktion ist jedoch im Gewebe exprimieren, wodurch die Besiedlung fremder Organismen wie Bakterien verhindert wird.
Was ist Ige?
Immunglobulin E oder IgE ist die Art von Immunglobulin, die am wenigsten im Serum gefunden wird. Es macht weniger als 0 aus.01 % der gesamten Serum -Immunglobuline. Seine Struktur ist monomer und die schwere Kette besteht aus dem ε -Typ. Darüber hinaus beträgt sein Molekulargewicht etwa 200.000 d. IGE hat zwei Antigenbindungsstellen, die denen von IgG ähneln.
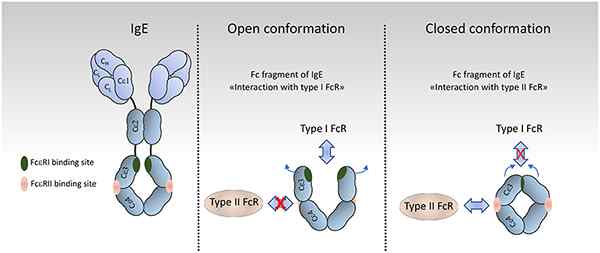
Abbildung 04: Unterschiedliche Bestätigungen von IGE
Die Hauptfunktion von IgE besteht darin, Allergiereaktionen als Reaktion auf Bedingungen wie Asthma und Heuse zu aktivieren. In einem breiteren Aspekt wird die IGE -Aktivierung bei Überempfindlichkeitsreaktionen vom Typ I -Typ I beobachtet. Als Reaktion auf die Interaktion zwischen Antikörper-Antigenen wird die Sekretion von Histaminen gefördert. Es hat nicht die Fähigkeit, das Komplementsystem zu aktivieren. Es spielt auch eine Rolle bei der Verteidigung gegen parasitäre Infektionen.
Was ist IGD?
Immunglobulin D oder IGD ist auch ein monomeres Immunglobulin mit nur 2 Antigenbindungsstellen. Es hat das niedrigste Molekulargewicht, ungefähr 185.000 d. IGD erklärt ungefähr <0.5% of the total antibody concentration in the serum. The heavy chain is composed of the δ type. The role of IgD is not highly specific, but they mainly take part in activating B cells during the adaptive immune response. They do not activate the complement system. They are unable to cross the placenta.
Was sind die Ähnlichkeiten zwischen IgG IgM Iga IgE und IGD?
- Alle bestehen aus schweren Ketten und leichten Ketten.
- Sie sind Glykoproteine.
- Darüber hinaus könnten alle Antikörpertypen die Antikörper-Antigen-Bindung erleichtern.
- Darüber hinaus wird die Bindung von Antikörpern-Antigens aufgrund des Vorhandenseins von Antigenbindungsstellen in allen Antikörpern erleichtert.
- Sie sind im Serum vorhanden.
- Alle nehmen an der Aktivierung adaptiver Immunantworten teil.
- Alle Antikörper könnten mit Immuntechniken wie dem Radio-Immuno-Assay (RIA) oder dem enzymgebundenen Immunosorbent-Assay (ELISA) nachgewiesen werden.
- Sie spielen eine wichtige Rolle in der Diagnostik und Pathologie.
Was ist der Unterschied zwischen IgG IgM Iga IgE und IGD?
Der Schlüsselunterschied zwischen IgG IgM Iga IgE und IGD ist die Art der schweren Kette, die jeder Antikörpertyp besitzt. IgG hat den γ -Typ der schweren Kette; IgM hat die μ schwere Kette; IgA hat eine α -Art der schweren Kette; IgE hat eine ε -Art der schweren Kette und IGD hat eine δ -Art der schweren Kette. Darüber hinaus variieren ihre strukturellen Anordnungen ebenfalls, was zu unterschiedlichen Molekulargewichten für jede Art von Antikörper führt. Darüber hinaus variiert auch die Art und Weise, wie jeder Antikörper wirkt. Während IgG und IgM das Komplementsystem aktivieren können, können die anderen Arten von Antikörpern dies nicht tun. Darüber hinaus kann nur IgG die Plazenta überqueren.
Die folgende Infografik stellt die Unterschiede zwischen IgG IgM Iga IgE und IGD in tabellarischer Form für Seite und Seitenvergleich dar.
Zusammenfassung -IgG vs IgM gegen Iga gegen IGE gegen IGD
Antikörper stammen aus B -Zellen und spielen eine wichtige Rolle bei der adaptiven Immunität. Es gibt fünf Hauptklassen von Antikörpern, die sich hauptsächlich auf der Art der schweren Kette unterscheiden, die sie besitzen. IgG IgM Iga IgE und IGD haben γ-, μ-, α-, ε- und δ -Arten von schweren Ketten. Darüber hinaus unterscheiden sie sich auch in ihren Strukturen, da IgG, IGE und IGD monomere Strukturen erreichen, IgM eine Pentamerstruktur erreicht und IgA eine dimere Struktur erreicht. Die Art und Weise, wie sie die Immunantworten aktivieren. IgG und IgM können das Komplementsystem aktivieren, aber die anderen Typen sind nicht. Dies ist also die Zusammenfassung des Unterschieds zwischen IgG IgM Iga IGE und IGD.
Referenz:
1. Schroeder, Harry W und Lisa Cavacini. „Struktur und Funktion von Immunglobulinen.”Das Journal of Allergy and Clinical Immunology, U.S. Nationalbibliothek für Medizin, Februar. 2010.
2. Vaillant, Angel a. Justiz. "Immunoglobulin.”Statpearls. U.S. Nationalbibliothek für Medizin, 12. Oktober. 2021.
Bild mit freundlicher Genehmigung:
1. „2220 Vier Kettenstruktur eines generischen Antikörper -IgG2 -Strukturen“ von OpenStax College - Anatomy & Physiology, Connexions -Website. 19. Juni 2013. (CC von 3.0) über Commons Wikimedia
2. „Immunglobulin (IgM) -Antikörper, die an benachbarte Antigenepitope auf der Oberfläche von Bakterienzellen binden“, durch SA1590 - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia
3. "3D -Struktur des sekretorischen Iga2" von Mcortnghh - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia
4. "Modus de fonctionnement du récecepteur fc avec une immunoglobuline e" von Ben Mkaddem Sanae, Benhamou Marc, Monteiro Renato C.Verständnis der FC -Rezeptor -Beteiligung an entzündlichen Erkrankungen: Von Mechanismen bis hin zu neuen therapeutischen Werkzeugen. Grenzen in der Immunologie 10.2019, Seite 811 (CC BY-SA 4.0) über Commons Wikimedia


