Was ist der Unterschied zwischen KM und Vmax
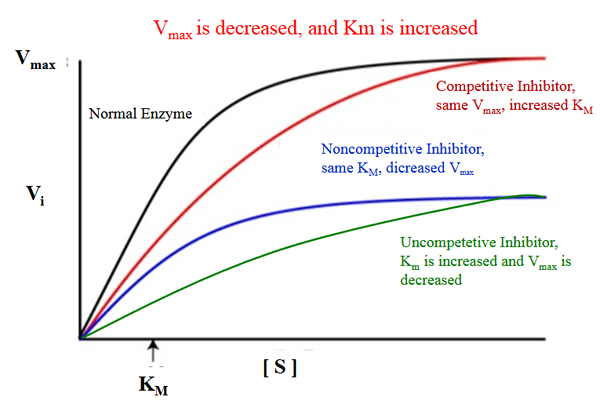
Der Schlüsselunterschied zwischen KM und Vmax ist, dass km misst, wie leicht ein Enzym durch das Substrat gesättigt werden kann, während Vmax die maximale Rate ist, mit der ein Enzym katalysiert wird, wenn das Enzym durch das Substrat gesättigt wird.
KM kann als Konzertation des Substrats beschrieben werden, bei dem die Hälfte der maximalen Geschwindigkeit erreicht wird. Vmax hingegen kann als Reaktionsgeschwindigkeit in dem Zustand beschrieben werden, in dem das Enzym durch das Substrat vollständig gesättigt ist.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist KM
3. Was ist vmax
4. Km vs vmax in tabellarischer Form
5. Zusammenfassung -km vs vmax
Was ist KM?
KM kann als Konzertation eines Substrats beschrieben werden, bei dem die Hälfte der maximalen Geschwindigkeit erreicht wird. Mit anderen Worten, es ist die Konzentration des Substrats, die es dem Enzym ermöglicht, einen halben Vmax zu erreichen. Daher zeigt ein Enzym mit einem hohen KM eine niedrige Affinität zu seinem Substrat. Es erfordert auch eine größere Konzentration des Substrats, um VMAX zu erreichen.
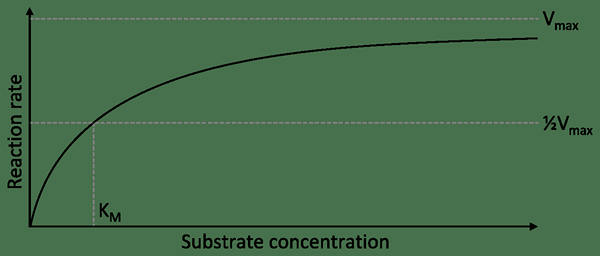
Der Begriff KM in der Enzymaktivität wird unter der Kinetik von Michaelis-Menten erörtert. Es ist ein gemeinsames Modell der Enzymkinetik. Dieses Modell wurde nach dem deutschen Biochemisten Leonor Michaelis und dem kanadischen Arzt Maud Menteen benannt. Dieses Modell wird als Gleichung ausgedrückt.
v = d [p]/dt = vmax ([s]/km+[s])
In der obigen Gleichung ist VMAX die maximale Rate, die durch das System erreicht wird, das bei der gesättigten Substratkonzentration für eine gegebene Enzymkonzentration auftritt. KM ist die Michaelis -Konstante. Wenn es numerisch gleich der Substratkonzentration ist, ist die Reaktionsgeschwindigkeit die Hälfte des Werts von VMAX.
Darüber hinaus wird häufig angenommen.
Was ist vmax?
Vmax kann als Reaktionsgeschwindigkeit in dem Zustand beschrieben werden, in dem das Enzym durch das Substrat vollständig gesättigt ist. Dieser Zustand zeigt an, dass alle Bindungsstellen ständig wieder besetzt werden. Mit anderen Worten, Vmax ist die maximale Reaktionsgeschwindigkeit oder -geschwindigkeit einer Reaktion, die bei der Sättigung des Enzyms mit seinem Substrat enzymatisch katalysiert wird.

Es ist wichtig, den KM und Vmax für eine bestimmte enzymatische Aktivität zu bestimmen, da wir diese Werte kennenlernen können. Ein niedrigerer Wert von VMAX zeigt an, dass das Enzym unter suboptimalen Bedingungen arbeitet.
Was ist der Unterschied zwischen KM und Vmax?
Die Begriffe KM und Vmax sind in der enzymatischen Kinetik wichtig. Der Schlüsselunterschied zwischen KM und VMAX besteht darin, dass km misst, wie leicht das Enzym durch das Substrat gesättigt werden kann, während Vmax die maximale Geschwindigkeit ist, mit der ein Enzym katalysiert wird, wenn das Enzym durch das Substrat gesättigt wird.
Die folgende Tabelle fasst den Unterschied zwischen KM und Vmax zusammen.
Zusammenfassung -km vs vmax
KM ist die Konzertation des Substrats, bei dem die Hälfte der maximalen Geschwindigkeit erreicht wird. Vmax ist die Reaktionsgeschwindigkeit in dem Zustand, in dem das Enzym durch das Substrat vollständig gesättigt ist. Der Schlüsselunterschied zwischen KM und VMAX besteht darin, dass km misst, wie leicht das Enzym durch das Substrat gesättigt werden kann, während Vmax die maximale Geschwindigkeit ist, mit der ein Enzym katalysiert wird, wenn das Enzym durch das Substrat gesättigt wird.
Referenz:
1. „Was sind enzymkinetische Assays? ein Überblick.” Tippbiosysteme, 20. Januar. 2022.
Bild mit freundlicher Genehmigung:
1. "Michaelis Menteen Curve 2" von Thomas Shafee - eigene Arbeit (CC von 4.0) über Commons Wikimedia
2. "Enzymkinetikkurve" von Imrankhan1992 - eigene Arbeit (CC0) über Commons Wikimedia


