Was ist der Unterschied zwischen dem Gesetz der Erhaltung der Masse und des Gesetzes des ständigen Anteils
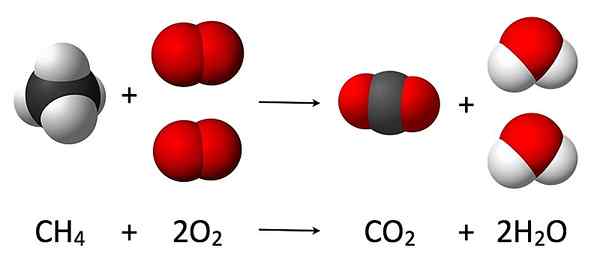
Der Schlüsselunterschied zwischen Massenschutz und Recht des ständigen Verhältnisses ist, dass das Gesetz der Erhaltung der Masse erklärt, dass Materie nicht erstellt oder zerstört werden kann, sondern in etwas anderes umgewandelt wird, während das Gesetz des ständigen Anteils erklärt, dass eine bestimmte chemische Verbindungen immer das gleiche Element in genau den gleichen Anteilen durch Masse enthalten.
Das Gesetz der Erhaltung von Massen und Recht der ständigen Verhältnisse sind beide Gesetze in der Chemie, die mit der Masse verbunden sind.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist das Gesetz der Massenschutz?
3. Was ist das Gesetz des ständigen Anteils?
4. Gesetz zur Erhaltung der Massenerhaltung gegen das Gesetz des ständigen Anteils in tabellarischer Form
5. Zusammenfassung -Gesetz des Massenschutzes gegen das Gesetz des ständigen Verhältnisses
Was ist das Gesetz der Massenschutz??
Das Massengesetz ist ein Gesetz, das besagt, dass in einem geschlossenen System, das für alle Übertragungen von Materie und Energie geschlossen ist. Dies bedeutet, dass sich die Masse des Systems im Laufe der Zeit nicht ändern kann, sodass die Menge weder hinzugefügt noch entfernt werden kann. Mit anderen Worten, die Masse wird im Laufe der Zeit erhalten. Es ist auch als Prinzip der Massenerhaltung bekannt.
Nach diesem Gesetz kann die Masse weder geschaffen noch zerstört werden, obwohl sie im Weltraum neu angeordnet werden kann. Darüber hinaus können die damit verbundenen Unternehmen die Formulare ändern. E.G. Die Masse der Reaktanten in einer chemischen Reaktion entspricht der Masse der Produkte. Daher entspricht die Gesamtmasse der Reaktanten bei chemischen Reaktionen und thermodynamischen Prozessen mit niedriger Energie, die der Masse der Produkte entspricht.

Wir können das Gesetz der Masse in der klassischen Mechanik formulieren, bei der die mit einem isolierten System verbundenen Energieskalen vergleichsweise kleiner sind als MC2 (M ist die Masse eines Objekts, und C ist die Lichtgeschwindigkeit). Dies muss im Referenzrahmen gemessen werden, in dem das Objekt ruht.
Was ist das Gesetz des ständigen Anteils??
Das Gesetz des ständigen Anteils behauptet, dass eine bestimmte chemische Verbindung immer aus ihren Komponentenelementen in einem festen Verhältnis durch Masse bestehen kann. Dies hängt nicht von seiner Quelle und der Vorbereitungsmethode ab. E.G. Mit der Masse hat Wasser etwa 8/9 Sauerstoff und 1/9 Wasserstoff.
Dieses Gesetz ist jedoch nicht universell wahr. Zum Beispiel gibt es nicht-stüchelndische Verbindungen mit einer Elementarzusammensetzung, die von Probe zu Probe variieren kann. Diese Verbindungen neigen dazu, das Gesetz mehrerer Anteile zu befolgen. Zum Beispiel kann Eisenoxid -Wustit Eisenatome im Bereich von 0 enthalten.83 bis 0.95 für jedes Sauerstoffatom (das bedeutet, dass es nicht zur Verfügung steht). Obwohl die ideale chemische Formel Feo ist, geben die kristallographischen Experimente ihr als Fe0.95Ö.
Zusätzlich variiert die isotopische Zusammensetzung eines Elements je nach Quelle. Daher trägt es sogar zur Masse einer reinen stöchiometrischen Verbindung bei, die variieren kann. Diese Variation ist nützlich bei der radiometrischen Datierung.
Was ist der Unterschied zwischen dem Gesetz der Erhaltung der Masse und des Gesetzes des ständigen Anteils?
Das Gesetz der Erhaltung von Massen und Recht der ständigen Verhältnisse sind beide Gesetze in der Chemie, die mit der Masse verbunden sind. Der Hauptunterschied zwischen dem Gesetz der Erhaltung von Massen und dem Gesetz des ständigen Anteils besteht darin Das gleiche Element in genau den gleichen Proportionen nach Masse.
Im Folgenden finden Sie eine Zusammenfassung des Unterschieds zwischen dem Gesetz der Masse und dem Gesetz des ständigen Anteils in der tabellarischen Form für Seite für Seitenvergleich.
Zusammenfassung -Gesetz des Massenschutzes gegen das Gesetz des ständigen Verhältnisses
Der Hauptunterschied zwischen dem Gesetz der Erhaltung von Masse und dem Gesetz des ständigen Anteils ist das Gesetz der Masseschutz, erklärt, dass Materie nicht geschaffen oder zerstört werden kann, sondern in etwas anderes umgewandelt werden kann, während das Gesetz des ständigen Verhältnisses erklärt, dass eine bestimmte chemische Verbindungen immer das gleiche enthalten Element in genau den gleichen Proportionen nach Masse.
Referenz:
1. „Proustes Gesetz des ständigen Verhältnisses.” Chemie -Libretexten, Libretexten, 11. September. 2022.
Bild mit freundlicher Genehmigung:
1. "Verbrennungsreaktion von Methan" von Jyntorobert A. Rohdejacek Fhjynto-Methane-3D-Raumfüllung.Svgoxygen Molekül VDW.pngcarbon-dioxid-3d-vdw.SVGWater -Molekül 3d.SVG (Public Domain) über Commons Wikimedia


