Was ist der Unterschied zwischen Lithiumcarbonat und Lithiumhydroxid
Der Schlüsselunterschied zwischen Lithiumcarbonat und Lithiumhydroxid ist, dass Lithiumcarbonat ein Carbonatanion enthält, das mit zwei Lithium -Kationen assoziiert ist, während Lithiumhydroxid ein Lithiumkation enthält.
Sowohl Lithiumcarbonat- als auch Lithiumhydroxid sind nützlich, um Kathodenmaterial für Lithium-Ionen-Batterien zu produzieren. Es gibt jedoch nur wenige Unterschiede zwischen diesen beiden Substanzen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Lithiumcarbonat
3. Was ist Lithiumhydroxid
4. Lithiumcarbonat gegen Lithiumhydroxid in tabellarischer Form
5. Zusammenfassung - Lithiumcarbonat gegen Lithiumhydroxid
Was ist Lithiumcarbonat?
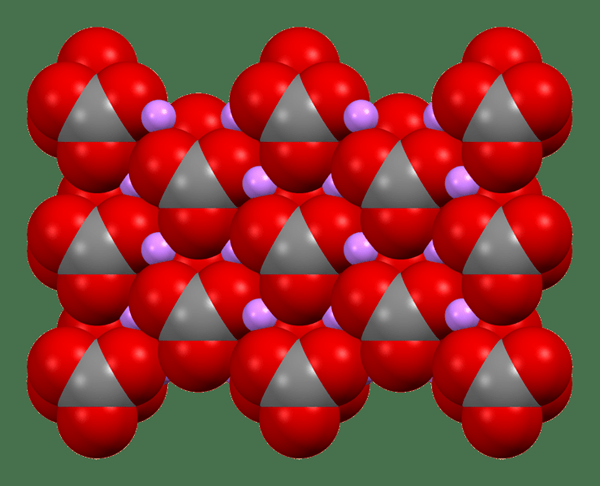
Lithiumcarbonat ist eine anorganische Verbindung mit der chemischen Formel Li2Co3. Es ist das Lithiumsalz von Kohlensäure. Es erscheint als weißes Pulver, das geruchlos ist. Es hat viele Anwendungen bei der Verarbeitung von Metalloxiden und ist auch als Medikament bei der Behandlung von Stimmungsstörungen nützlich. Zum Beispiel ist es eines der wichtigsten Medikamente zur Behandlung von bipolaren Störungen.

Abbildung 01: Die Kristallstruktur von Lithiumcarbonat
In industriellen Anwendungen ist Lithiumcarbonat als Vorläufer für Verbindungen, die wir bei der Herstellung von Lithium-Ionen-Batterien verwenden, sehr wichtig. Darüber hinaus sind Gläser, die aus Lithiumcarbonat hergestellt werden, für die Ofenwarenproduktion sehr wichtig. Wir können diese Verbindung sowohl als häufiger Bestandteil in Low-Fire- als auch in Hochfeuer-Keramikglasur finden. Es kann zusammen mit Kieselsäure und anderen Materialien niedrig melkte Flüsse bilden. Darüber hinaus verursachen die alkalischen Eigenschaften von Lithiumcarbonat die Änderung des Zustands der Metalloxidfarbe in der Glasur. E.G. Rotes Eisenoxid. Abgesehen davon neigt Cement dazu, schneller zu setzen, wenn es mit Lithiumcarbonat hergestellt wird.
Was ist Lithiumhydroxid?
Lithiumhydroxid ist eine anorganische Verbindung mit der chemischen Formel Lioh. Es gibt zwei Formen; Sie sind die hydratisierte Form und die wasserfreie Form. Die Anzahl der Wassermoleküle in der hydratisierten Form kann unterschiedlich sein. Sowohl hydratisierte als auch wassere Formen sind hygroskopische Feststoffe, die in Wasser löslich und in Ethanol leicht löslich sind. Darüber hinaus sind beide Formen für verschiedene Anwendungen im Handel erhältlich. Wir können es als starke Basis klassifizieren. Es ist jedoch das schwächste Alkali -Metallhydroxid, das bisher bisher bekannt ist.
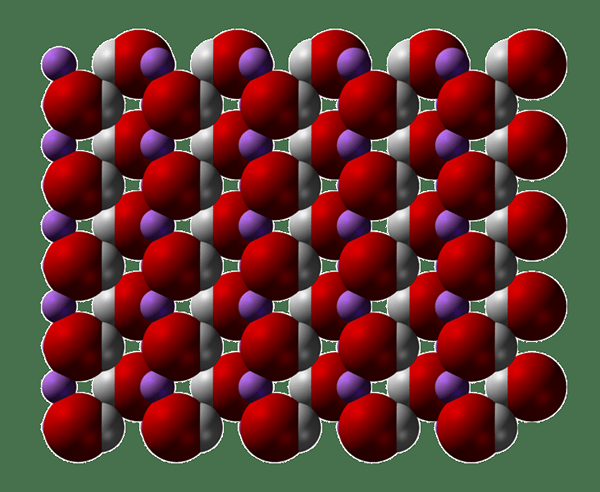
Abbildung 02: Die Kristallstruktur von Lithiumhydroxid
Das Hard -Rock -Spodumen ist der Ausgangsmaterial für die Herstellung von Lithiumhydroxid. Diese Verbindung hat ihren Lithiumgehalt als Prozentsatz von Lithiumoxid exprimiert. Oft erzeugt die Produktion von Lithiumhydroxid unter Verwendung von Metathesereaktionen unter Verwendung von Calciumhydroxid. Als alternativer Weg können wir Lithiumsulfat verwenden.
Es gibt viele wichtige Verwendungen von Lithiumhydroxid, einschließlich der Herstellung von Lithium-Ionen-Batterien, als Fettverdicker bei Atemgasreinigungssystemen für Raumfahrzeuge, als Zwischenprodukte für die Herstellung anderer lithiumhaltiger Verbindungen bei der Herstellung von Keramik für die Alkalisierung usw.
Was ist der Unterschied zwischen Lithiumcarbonat und Lithiumhydroxid?
Sowohl Lithiumcarbonat- als auch Lithiumhydroxid sind nützlich, um Kathodenmaterial für Lithium-Ionen-Batterien zu produzieren. Es gibt jedoch nur wenige Unterschiede zwischen Lithiumcarbonat und Lithiumhydroxid. Unter ihnen besteht der Hauptunterschied zwischen Lithiumcarbonat und Lithiumhydroxid darin, dass Lithiumcarbonat ein Carbonatanion enthält, das mit zwei Lithiumkationen assoziiert ist, während Lithiumhydroxid ein Lithiumkation enthält, das mit einem Hydroxidanion assoziiert ist. Darüber hinaus ist Lithiumcarbonat günstiger als Lithiumhydroxid.
Zusammenfassung -Lithiumcarbonat gegen Lithiumhydroxid
Lithiumcarbonat und Lithiumhydroxid sind wichtige anorganische Verbindungen. Der Hauptunterschied zwischen Lithiumcarbonat und Lithiumhydroxid besteht darin. Darüber hinaus ist Lithiumcarbonat günstiger als Lithiumhydroxid.
Referenz:
1. „Lithiumcarbonat.” Ein Überblick | Sciencedirect -Themen.
Bild mit freundlicher Genehmigung:
1. "Lithium-carbonat-textal-1979-Mercury-3d-SF" von Ben Mills-eigene Arbeit (Public Domain) über Commons Wikimedia
2. "Lithium-hydroxid-textal-3D-SF" von CCOIL (DEVK)-eigene Arbeit (CC von 3.0) über Commons Wikimedia