Was ist der Unterschied zwischen monoprotischer und diprotischer Säure
Der Schlüsselunterschied zwischen monoprotischer und diprotischer Säure ist, dass monoprotische Säuren in der Lage sind, ein Wasserstoffatom oder Proton an ihre wässrige Lösung zu spenden, während diprotische Säuren zwei Wasserstoffatome oder Protonen für ihre wässrige Lösung spenden können.
Monoprotische und diprotische Säureverbindungen sind zwei signifikante Gruppen saurer Substanzen. Diese Verbindungen können Protonen für ihre wässrigen Lösungen freisetzen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist eine monoprotische Säure
3. Was ist eine diprotische Säure
4. Monoprotische gegen diprotische Säure in tabellarischer Form
5. Zusammenfassung - monoprotische gegen diprotische Säure
Was ist eine monoprotische Säure?
Eine monoprotische Säure ist eine Säure, die aus einem ionisierbaren Wasserstoffatom pro Molekül besteht. Diese Art von Säure kann nur ein Proton oder Wasserstoffatom von einem Säuremolekül bis zu seiner wässrigen Lösung spenden. Andererseits werden die Säuren, die mehr als ein Proton oder Wasserstoffatom an die wässrige Lösung spenden können. Diese polyprotischen Säuren können basierend auf der Anzahl der Protonen, die von jedem Molekül gespendet werden, weiter in Gruppen eingeteilt werden. Wenn beispielsweise ein Säuremolekül zwei Protonen oder Wasserstoffatome spendet, ist es als diprotische Säure bekannt; Wenn drei gespendet werden, ist es als Tripotic Säure bekannt und so weiter.
Typischerweise kann die elektrische Ladung einer monoprotischen Säure auf ein höheres Niveau springen, bevor sie den Proton verschenken kann. Darüber hinaus können wir vorhersagen, dass jede Säure mit einem Wasserstoffatom pro Molekül eine monoprotische Säure ist. Daher sind alle Einzelhydrogensäuren monoprotisch. Allerdings haben nicht alle monoprotischen Säuren nur ein Wasserstoffatom. Zum Beispiel kann es Verbindungen mit mehr als einem Wasserstoffatom pro Molekül geben, aber sie können möglicherweise nur ein Wasserstoffatom freisetzen.
Da wir nur ein Wasserstoffatom gespendet werden, können wir den pH -Wert einer monoprotischen Säure leicht vorhersagen und berechnen. Im Gegensatz dazu kann eine monoprotische Base nur ein Proton oder Wasserstoffatom akzeptieren. Einige Beispiele für monoprotische Säuren sind Salzsäure, Salpetersäure, Essigsäure usw.
Was ist eine diprotische Säure?
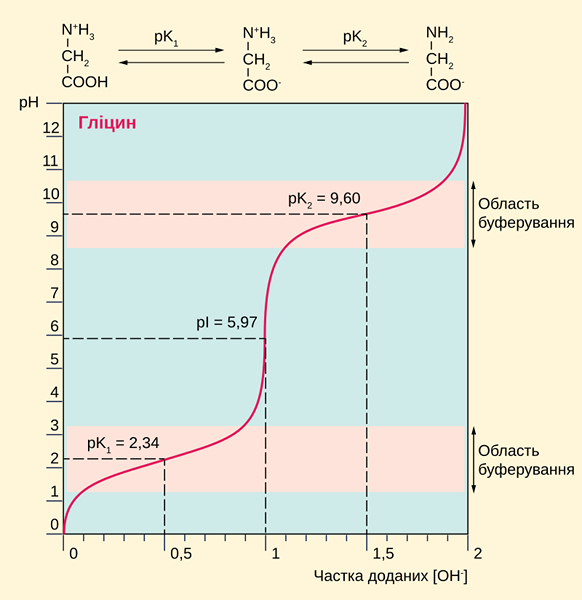
Diprotische Säuremoleküle sind Säuren, die zwei Protonen oder Wasserstoffatome pro Molekül spenden können. Diese Art von Säure kann zwei Protonen für seine wässrige Lösung spenden. Der entgegengesetzte Begriff für dipotische ist monoprotisch (dh ein Protonen oder Wasserstoffatom pro Molekül). Einige häufige Beispiele für diprotische Säuren sind Schwefelsäure, Kohlensäure und Oxalsäure.

Abbildung 01: Glycin ist eine diprotische Säure (Diese Kurve zeigt die pH -Werte, bei denen die beiden Protonen an die wässrige Lösung gespendet werden.)
Diprotische Säuren können zwei H+ -Ionen pro Säuremolekül ergeben. Daher können diese Säuren die Wasserstoffionenkonzentration von Lösungen erhöhen und dadurch den pH -Wert aufgrund hoher Säure verringern. Wir können eine diprotische Säure identifizieren, indem wir sie mit einer Natriumhydroxidlösung mit einer bekannten Konzentration titrieren.
Was ist der Unterschied zwischen monoprotischer und diprotischer Säure?
Der wichtigste Unterschied zwischen monoprotrotischer und diprotischer Säure besteht darin, dass monoprotische Säuren ein Wasserstoffatom oder Proton an ihre wässrige Lösung spenden können, während diprotische Säuren zwei Wasserstoffatome oder Protonen an ihre wässrige Lösung spenden können. Salzsäure, Salpetersäure und Essigsäure sind Beispiele für monoprotische Säuren, während Schwefelsäure, Kohlensäure und Oxalsäure Beispiele für diprotische Säuren sind. Insgesamt sind monoprotische Säuren saurer als diprotische Säuren.
Die folgende Infografik zeigt die Unterschiede zwischen monoprotischen und diprotischen Säure in tabellarischer Form für den Nebenseitigen Vergleich.
Zusammenfassung - monoprotische gegen diprotische Säure
Der wichtigste Unterschied zwischen monoprotrotischer und diprotischer Säure besteht darin, dass monoprotische Säuren ein Wasserstoffatom oder Proton an ihre wässrige Lösung spenden können, während diprotische Säuren zwei Wasserstoffatome oder Protonen an ihre wässrige Lösung spenden können.
Referenz:
1. Helmenstine, Anne Marie. „Monoprotische Säuredefinition.”Thoughtco, August. 27, 2020.
Bild mit freundlicher Genehmigung:
1. "Glycintitrationskurve" von Zlir'a - eigene Arbeit (CC0) über Commons Wikimedia


