Was ist der Unterschied zwischen PFK-1 und PFK-2
Der Schlüsselunterschied Zwischen PFK-1 und PFK-2 katalysiert PFK-1 die Umwandlung von Fructose 6-phosphat und ATP in Fructose 1,6-Bisphosphat und ADP, während PFK-2 die Synthese von Fructose 2,6-Bisphosphat aus Fructose 6- 6- katalysiert Phosphat.
Phosphofroctokinase-1 (PFK-1) und Phosphofroctokinase-2 (PFK-2) sind zwei Enzyme. PFK-1 ist ein glykolytisches Enzym. Es ist der geschwindigkeitsbegrenzende Schritt der Glykolyse. Wenn der Glukosespiegel hoch ist und die Glykolyse regulieren muss, katalysiert PFK-2 die Synthese von Fructose 2,6-Bisphosphat aus Fructose 6-Phosphat. Fructose 2,6-Bisphosphat ist ein leistungsstarker allosterischer Aktivator von PFK-1, um den Zusammenbruch von Glukose zu verbessern. PFK-2 ist kein glykolytisches Enzym. Aber sowohl PFK-1 als auch PFK-2 wirken auf demselben Substrat.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist PFK-1
3. Was ist PFK-2
4. Ähnlichkeiten-PFK-1 und PFK-2
5. PFK-1 gegen PFK-2 in tabellarischer Form
6. Zusammenfassung-PFK-1 gegen PFK-2
Was ist PFK-1?
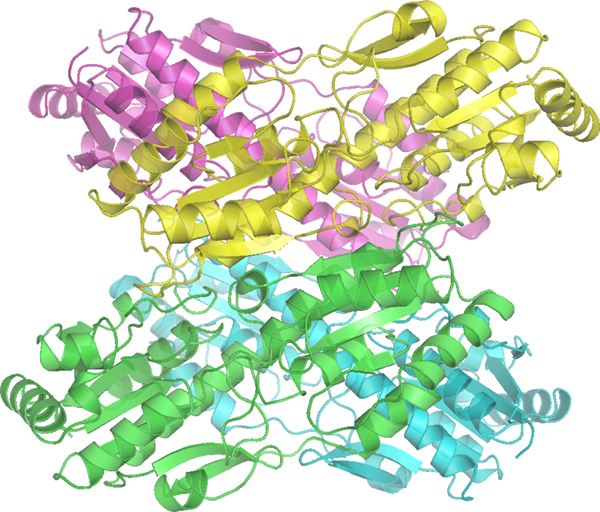
PFK-1 ist das erste engagierte Enzym in der Glykolyse. Tatsächlich ist es das geschwindigkeitsbegrenzende Enzym der Glykolyse. Es katalysiert die Umwandlung von Fructose 6-phosphat in Fructose 1,6-Bisphoshat. PFK-1 verwendet ATP für diese Reaktion. Daher wird PFK-1 durch die ATP-Konzentration beeinflusst. Die Hemmung von PFK-1 durch ATP ist Teil der negativen Rückkopplungsschleife, die den Glykolysefluss unter einem aeroben Zustand reguliert. Anders als durch ATP wird die PFK-1-Aktivität durch mehrere andere Moleküle reguliert, darunter Fructose 2,6-Bisphosphat, AMP und Citrat.

Abbildung 01: PFK-1
Fructose 2,6-Bisphosphat ist ein starker allosterischer Aktivator von PFK-1. Bei physiologischen Bedingungen bleibt PFK-1 inaktiv bleibt inaktiv. Wenn es mit Fructose 2,6-Bisphoshat interagiert, wird es aktiv und stimuliert den glykolytischen Weg, um den Glukoseabbau zu erhöhen. Der Fluss in Richtung der Glykolyse wird durch die Fructose 2,6-Bisphosphat aufgrund seiner Fähigkeit einer allosterischen Aktivierung von PFK-1 erheblich erhöht. In ähnlicher Weise fungiert AMP auch als allosterischer Effektor, um PFK-1 zu aktivieren. Im Gegensatz dazu wirkt Citrat als allosterischer Inhibitor von PFK1. Magnesium wirkt als Co-Faktor für PFK-1.
Was ist PFK-2?
Fructose 2,6-Bisphosphat ist ein Metaboliten, das die Glykolyse und Glukoneogenese reguliert. PFK-2 oder Phosphofructokinase-2 ist das Enzym, das die Synthese von Fructose 2,6-Bisphosphat aus Fructose 6-Phosphat katalysiert. Ähnlich wie PFK-1 wirkt PFK-2 auf demselben Substrat. Im Gegensatz zu PFK-1 wird die PFK-2-Aktivität jedoch nicht durch die ATP-Konzentration beeinflusst. Phosphoenolpyruvat und Citrat können dieses Enzym hemmen, während anorganisches Orthophosphat die Wirkung von PFK-2 stimulieren kann.
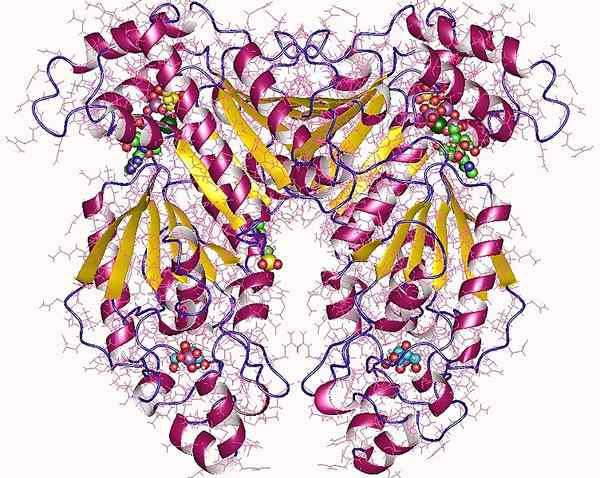
Abbildung 02: PFK-2
Strukturell existiert PFK-2 mit Fructose-2,6-Bisphosphatase als bifunktionell. PFK-2 phosphoryliert Fructose 6-phosphat unter Verwendung von ATP. Andererseits dephosphoryliert FBPase-2 Fructose 2,6-Bisphosphat, um Fructose 6-Phosphat und PI zu produzieren. Daher hat PFK-2 sowohl Kinase- als auch Phosphataseaktivitäten. Wenn der Glukosespiegel hoch ist, erhöht Insulin die Kinaseaktivität des PFK-2-Enzyms, um die erhöhte Synthese von Fructose 2,6-Bisphosphat voranzutreiben. Es stimuliert die Glykolyse aufgrund der Aktivierung von PFK-1 durch Fructose 2,6-Bisphosphat. Im Gegensatz dazu bricht die Phosphataseaktivität von PFK-2 Fructose 2,6-Bisphosphat wieder in Fructose 6-phosphat, stimuliert die Glukoneogenese und hemmt die Glykolyse.
Was sind die Ähnlichkeiten zwischen PFK1 und PFK-2?
- PFK-1 und PFK-2 sind zwei Enzyme.
- Das Substrat von PFK-1- und PFK-2-Enzymen ist gleich: Fructose 6-Phosphat.
- Beide Enzyme sind wichtig für die Regulation der Glykolyse.
- Die durch beide Enzyme katalysierten Reaktionen ergeben ADP aus ATP.
- Citrat kann diese beiden Enzyme hemmen.
Was ist der Unterschied zwischen PFK-1 und PFK-2?
PFK-1 katalysiert die Umwandlung von Fructose 6-phosphat in Fructose 1,6-Bisphosphat. Im Gegensatz dazu katalysiert PFK-2 die Umwandlung von Fructose 6-phosphat in Fructose 2,6-Bisphosphat. Dies ist also der Hauptunterschied zwischen PFK1 und PFK-2. Im Gegensatz zu PFK-1 hat PFK-2 sowohl die Kinase- als auch die Phosphataseaktivität; Daher handelt es sich um ein bi-funktionales Enzym. Darüber hinaus ist Fructose 2,6-Bisphosphat ein starker allosterischer Aktivator von PFK-1, während PFK-2 die Synthese von Fructose 2,6-Bisphosphat katalysiert. Somit ist dies ein weiterer Unterschied zwischen PFK-1 und PFK-2. Am wichtigsten ist, dass die PFK-1-Aktivität durch ATP beeinflusst wird, während die PFK-2-Aktivität nicht durch die ATP-Konzentration beeinflusst wird.
Die folgende Infografik listet die Unterschiede zwischen PFK-1 und PFK-2 in tabellarischer Form für Seite für Seitenvergleich auf.
Zusammenfassung-PFK-1 gegen PFK-2
PFK-1 katalysiert die Umwandlung von Fructose 6-phosphat und ATP in Fructose 1,6-Bisphosphat und ADP. PFK-2 katalysiert die Synthese von Fructose 2,6-phosphat aus Fructose 6-phosphat. Die PFK-1-Aktivität wird durch die ATP-Konzentration beeinflusst. Im Gegensatz dazu wird PFK-2 nicht durch die ATP-Konzentration beeinflusst. Am wichtigsten ist, dass PFK-2 sowohl Kinase- als auch Phosphataseaktivitäten hat. Daher handelt es sich um ein bi-funktionales Enzym. PFK-1 ist kein bi-funktionales Enzym. Darüber hinaus ist PFK-1 ein geschwindigkeitsbegrenzter Enzym der Glykolyse, während PFK-2 nicht als glykolytisches Enzym angesehen wird. Dies ist daher die Zusammenfassung des Unterschieds zwischen PFK-1 und PFK-2.
Referenz:
1. Ros, Susana und Almut Schulze. „Glykolytischer Fluss ausbalancieren.”Krebs & Stoffwechsel, Biomed Central, 4. Februar. 2013.
2. „Phosphofructokinase 2.”Wikipedia, Wikimedia Foundation, 5. Juli 2021.
Bild mit freundlicher Genehmigung:
1. "Phosphofroctokinase 6PFK WPMP" von Zephyris bei englischer Wikipedia - übertragen von EN.Wikipedia nach Commons von Patríciar. (CC BY-SA 3.0) über Commons Wikimedia
2. "5HTK" von Ablagerungsautoren: Crochet, R.B.; Visualisierungsautor: Benutzer: Astrojan -(CC BY -SA 4.0) über Commons Wikimedia


