Was ist der Unterschied zwischen positivem und negativem Allosterismus
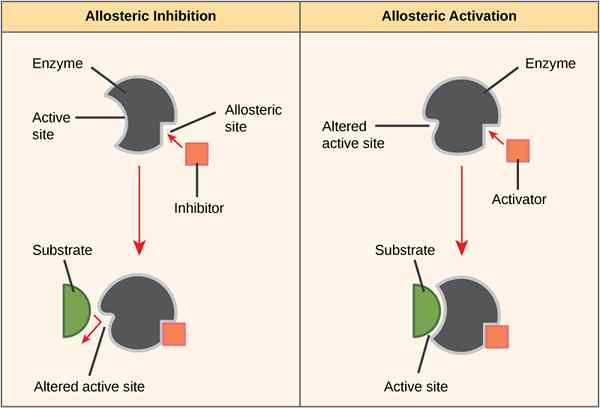
Der Schlüsselunterschied zwischen positivem und negativem Allosterismus ist, dass ein positiver Allosterismus in Proteinen eine hohe Affinität zu Liganden zeigt, während negativer Allosterismus in Proteinen eine geringe Affinität zu Liganden aufweist.
Allosterismus oder allosterisches Verhalten ist das Phänomen, bei dem die Aktivität eines Proteins abhängig von der Bindung einiger Moleküle an einer anderen Stelle als der aktiven Stelle des Proteins (insbesondere in Enzymen) verändert werden kann. Ein positiver Alosterismus zeigt, dass die Bindung eines Effektormoleküls an ein Enzym dazu führt, dass das Enzym seine Konfiguration in eine aktive Form verwandelt. Im Gegensatz dazu zeigt ein negativer Allostreirsm an, dass eine Effektormolekülbindung dazu führt, dass das Enzym seine Konfiguration von einer aktiven Form in eine inaktive Form ändert.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist positiver Alosterismus
3. Was ist negativer Allosterismus
4. Positiver gegen negativer Allosterismus in tabellarischer Form
5. Zusammenfassung -positiver gegen negativer Allosterismus
Was ist positiver Alosterismus?
Positiver Allosterismus ist die Veränderung der Konfiguration eines Proteins (hauptsächlich eines Enzyms) von einer inaktiven Form zu einer aktiven Form bei der Bindung eines Effektormoleküls. Das Effektormolekül bindet mit einer anderen Stelle als der aktiven Stelle des Enzyms; Es wird als allosterische Seite bezeichnet. Dieser Prozess ist auch als bekannt als allosterische Aktivierung.
Ein häufiges Beispiel für eine solche Effektormolekülbindung ist die Bindung von Sauerstoffmolekül mit Hämoglobinmolekül, das das Hämoglobinmolekül aktiviert, um Sauerstoff effektiv in Zellen zu transportieren. Dort bindet das Sauerstoffmolekül mit dem Eiseneisen eines Hämmoleküls im Hämoglobinmolekül. Die aktive Form ist als Oxy-Hemoglobin bekannt, während die inaktive Form als Desoxy-Hemoglobin bezeichnet wird.
Was ist negativer Allosterismus?
Negativer Allosterismus ist die Änderung der Konfiguration eines Enzyms von einer aktiven Form zu einer inaktiven Form bei der Bindung eines Effektormoleküls. Das Effektormolekül bindet mit einer anderen Stelle als der aktiven Stelle des Enzyms; Es wird als allosterische Seite bezeichnet. Dieser Prozess ist auch als bekannt als allosterische Hemmung.

Abbildung 01: positiver und negativer Allosterismus
Während des negativen Allosterismus verringert die Bindung eines Liganden die Affinität des Enzyms zum Substrat an den anderen aktiven aktiven Stellen, die für die Substratbindung verfügbar sind. Beispiel.
Was ist der Unterschied zwischen positivem und negativem Allosterismus?
In einem positiven Allosterismus führt die Bindung eines Effektormoleküls an ein Enzym dazu. Der Hauptunterschied zwischen positivem und negativem Allosterismus besteht darin, dass ein positiver Allosterismus in Proteinen eine hohe Affinität zu Liganden zeigt, während negativer Allosterismus in Proteinen eine geringe Affinität für Liganden aufweist. Darüber hinaus beinhaltet ein positiver Allosterismus die Aktivierung, während negativer Allostreirsm eine Hemmung beinhaltet. Die Bindung von Sauerstoff mit Hämoglobin ist ein Beispiel für einen positiven Allosterismus bei der Bindung von 2,3-bpg mit Hämoglobin ist ein Beispiel für negatives Allosterismus.
Die folgende Infografik stellt den Unterschied zwischen positivem und negativem Allosterismus in tabellarischer Form für Seite an Seitenvergleich auf.
Zusammenfassung -positiver gegen negativer Allosterismus
Im Allosterismus oder allosterischen Verhalten kann die Aktivität eines Proteins abhängig von der Bindung einiger Moleküle an einer anderen Stelle als der aktiven Stelle des Proteins (insbesondere in Enzymen) verändert werden. Der Hauptunterschied zwischen positivem und negativem Allosterismus besteht darin, dass ein positiver Allosterismus in Proteinen eine hohe Affinität zu Liganden zeigt, während negativer Allosterismus in Proteinen eine geringe Affinität für Liganden aufweist.
Referenz:
1. "3.6: Allosterische Wechselwirkungen.” Chemie -Libretexten, Libretexten, 17. Juli 2020.
Bild mit freundlicher Genehmigung:
2. "Abbildung 06 05 05 - Allosterische Aktivierung und Hemmung" von CNX OpenStax - (CC von 4.0) über Commons Wikimedia


