Was ist der Unterschied zwischen Protineräure und Lewis -Säure
Der Schlüsselunterschied zwischen Protizensäure und Lewis -Säure ist, dass Protonensäuren Protonenspender sind, während Lewis -Säuren Protonenakzeptoren sind.
Protikelsäuren sind chemische Verbindungen, die ein Proton oder ein Hydroniumion in ihrer Lösung durch Freisetzung eines Protons produzieren können. Eine Lewis-Säure ist eine chemische Verbindung, die ein Elektronenpaar aus einer elektronenspendenden chemischen Spezies akzeptieren kann.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Protineräure
3. Was ist Lewis Säure
4. Protinsäure gegen Lewis -Säure in tabellarischer Form
5. Zusammenfassung - Protineräure gegen Lewis -Säure
Was ist Protineräure?
Protiktäuren sind chemische Verbindungen, die durch Freisetzung eines Protons ein Proton oder ein Hydroniumion produzieren können. Diese Protonenfreisetzung kommt auf.
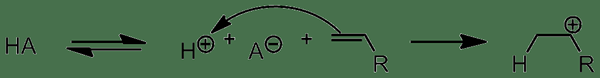
Abbildung 01: Wirkung von Protiensäuren
Es gibt drei Haupttypen von Protokollsäuren als monoprotische Säuren, polyprotische Säuren und diprotische Säuren . Monoprotische Säuren können ein Proton für die Lösung freisetzen, während diprotische Säuren zwei Protonen freisetzen können. Andererseits können polyprotische Säuren mehr als zwei Protonen freisetzen. In polyprotischen Säuren werden die Protonen in mehreren Schritten freigesetzt. Das erste Proton geht jedoch leichter aus der Säure verloren als der nächste Proton.
Was ist Lewis Säure?
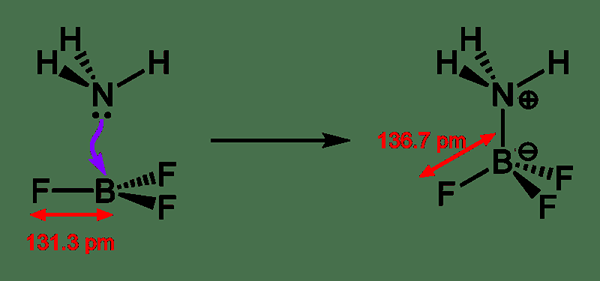
Eine Lewis-Säure ist eine chemische Verbindung, die ein Elektronenpaar aus einer elektronenspendenden chemischen Spezies akzeptieren kann. Diese Art von saurer Verbindung enthält ein leeres Orbital, das ein Elektronenpaar von einer Lewis -Basis akzeptieren kann, wodurch ein Lewis -Addukt bildet. Im Gegensatz dazu ist Lewis Base eine chemische Spezies mit einem gefüllten Orbital, das aus einem Elektronenpaar besteht. Dieses Elektronenpaar beteiligt sich nicht an der Bindung, aber es kann Dativbindungen mit Lewis -Säuren bilden, um ein Lewis -Addukt zu bilden.

Abbildung 02: Bildung eines Lewis -Addukts
Typischerweise wird der Begriff Lewis -Säure nur mit trigonalen planaren chemischen Verbindungen verwendet, die ein leeres P -Orbital enthalten. Dort können wir sogar komplexe Verbindungen wie et3al2cl3 als trigonale planare Verbindungen behandeln, die als Lewis -Säuren bezeichnet werden können. Abgesehen von der Bildung von Lewis-Addukten werden andere Reaktionen mit Lewis-Säuren als säurebatalysierte Reaktionen bezeichnet. Manchmal stoßen wir auf chemische Verbindungen wie H2O mit Lewis -Säure- und Lewis -Baseneigenschaften. Dies liegt daran, dass diese Verbindungen je nach chemischer Reaktion, an der sie beteiligt sind.
Es gibt verschiedene Lewis -Säuren. Die einfachsten Lewis -Säuren reagieren dazu, einfach und direkt mit Lewis -Basen zu reagieren. Die häufigsten Lewis -Säuren unterziehen sich vor der Bildung des Addukts einer chemischen Reaktion. Einige Beispiele für Lewis-Säuren sind Oniumionen wie Ammoniumion und Hydroniumion, Metallkationen wie Eisen Ionen, trigonale planare Spezies wie BF3, elektronenarme PI-Systeme wie Enones usw. Die drei Haupttypen von Lewis -Säuren umfassen einfache Lewis -Säuren, komplexe Lewis -Säuren und H+ Lewis -Säure. Die häufigste Anwendung von Lewis-Säuren ist die Friedel-Crafts-Alkylierung.
Was ist der Unterschied zwischen Protineräure und Lewis -Säure?
Wir können Protonensäuren von Lewis -Säuren durch die Wirkung der Protonenfreisetzung aus der Säureverbindung unterscheiden. Der wichtigste Unterschied zwischen Protonensäure und Lewis -Säure besteht darin, dass Protonensäuren Protonenspender sind, während Lewis -Säuren Protonenakzeptoren sind.
Die folgende Infografik stellt den Unterschied zwischen Prot- und Lewis -Säure in tabellarischer Form dar.
Zusammenfassung -Protineräure gegen Lewis -Säure
Zusammenfassend unterscheiden sich Proticäuren in Abhängigkeit von der Fähigkeit dieser Verbindungen von Lewis -Säuren, Protonen auf die Lösung abzugeben. Der wichtigste Unterschied zwischen Protonensäure und Lewis -Säure besteht darin, dass Protonensäuren Protonenspender sind, während Lewis -Säuren Protonenakzeptoren sind.
Referenz:
1. „Polyprotische Säuren und Basen.” Chemie -Libretexten, Libretexten, 15. August. 2020.
Bild mit freundlicher Genehmigung:
1. "Protic Säure Initiation" von Matchem121 - eigene Arbeit (CC von 3.0) über Commons Wikimedia
2. "NH3-BF3-Adduct-Bond-Länge-2D" von Ben Mills-eigene Arbeit (Public Domain) über Commons Wikimedia


