Was ist der Unterschied zwischen Serin und Threonin
Der Schlüsselunterschied zwischen Serin und Threonin ist, dass Serin eine nicht esszielle Aminosäure ist, die eine α-Amino-Gruppe, eine Carboxylgruppe und eine Seitenkette enthält, die aus einer Hydroxymethylgruppe besteht eine Seitenkette, die aus einer Hydroxylgruppe besteht.
Aminosäuren sind die Vorläufer, um komplexe Proteine herzustellen. Sie sind organische Verbindungen, die Amino (NH) enthalten3+) Carboxyl (COO-) funktionelle Gruppen. Es gibt vier wichtigste Aminosäurenklassen, die auf Polarität basieren. Es handelt sich um Aminosäuren mit nichtpolaren Seitenketten (Tryptophan), Aminosäuren mit ungeladenen polaren Seitenketten (Serin, Threonin), Aminosäuren mit polar negativ geladenen Seitenketten (Asparaginsäure) und Aminosäuren mit polar positiv geladenen Seitenketten ( Lysin). Serin und Threonin sind zwei Aminosäuren mit ungeladenen polaren Seitenketten.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Serin
3. Was ist Dreionin
4. Ähnlichkeiten - Serin und Threonin
4. Serin gegen Threonin im tabellarischen Format
5. Zusammenfassung -Serin gegen Threonin
Was ist Serin?
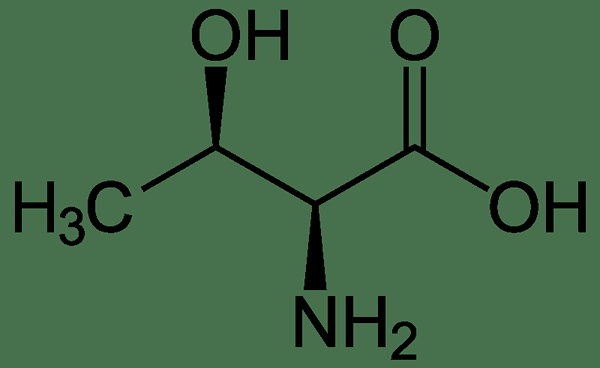
Serin ist eine Aminosäure, die eine α-Amino-Gruppe, eine Carboxylgruppe und eine Seitenkette enthält, die aus einer Hydroxymethylgruppe besteht. Es ist eine Aminosäure mit einer ungeladenen polaren Seitenkette. Daher wird es als polare Aminosäure eingestuft. Es kann unter normalen physiologischen Bedingungen im menschlichen Körper im menschlichen Körper synthetisiert werden. Dies macht es zu einer nicht wesentlichen Aminosäure. Es wird normalerweise durch Codons UCU, UCC, UCA, UCG, AGU und AGC im genetischen Code codiert. Diese organische Verbindung ist eine der natürlich vorkommenden proteinogenen Aminosäuren. Es wurde erstmals 1865 von Emil Cramer aus Seidenprotein erhalten. Nahrungsquellen, die reich an L -Stereoisomer von Serin sind, sind Eier, Lamm, Leber, Edamame, Tofu, Schweinefleisch -Sardinen, Seetang usw. Industriell kann Serin aus Glycin und Methanol produziert werden, die durch die Enzymhydroxymethyltransferase katalysiert werden.
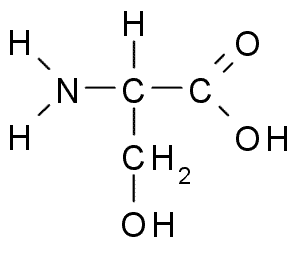
Abbildung 01: Serin
Serin hat zahlreiche biologische Funktionen. Es nimmt an der Biosynthese von Purinen und Pyrimidinen teil. Serin spielt auch eine wichtige Rolle bei der katalytischen Funktion vieler Enzyme wie Chymotrypsin und Trypsin. Darüber hinaus ist D-Serin ein Signalmolekül im Gehirn. Serinmangel führt zu Störungen wie schweren neurologischen Symptomen wie angeborenen Mikrozephalie, schwerer psychomotorischer Behinderung. Der Mangel an Serin kann auch schwerlebbare Anfälle verursachen.
Was ist Dreionin?
Threonin ist eine Aminosäure, die eine α-Amino-Gruppe, eine Carboxylgruppe und eine Seitenkette enthält, die aus der Hydroxylgruppe besteht. Es ist auch eine Aminosäure mit einer ungeladenen polaren Seitenkette. Es ist eine essentielle Aminosäure für den Menschen, da sie unter normalen physiologischen Bedingungen im menschlichen Körper nicht synthetisiert werden kann. Es muss aus der Ernährung erhalten werden. Threonin wird aus Aspartat in Bakterien synthetisiert E.coli. Es wird von den Codons ACU, ACC, ACA und ACG im genetischen Code codiert. Diese Aminosäure wurde erstmals 1936 von William Cumming Rose und Curtis Mayer entdeckt. Erwachsene Menschen benötigen Threonin etwa 20 mg/kg Körpergewicht pro Tag. Das in Dreionin reichhaltige Essen umfasst Hüttenkäse, Geflügel, Fisch, Fleisch, Linsen, schwarze Schildkrötenbohnen und Sesamsamen.

Abbildung 02: Threonine
Threonin erfüllt unterschiedliche biologische Funktionen. Es ist ein wichtiger Bestandteil des Magen -Darm -Mucin. Threonin ist auch ein Ernährungsmodulator des Darm -Immunsystems über komplexe Signalnetzwerke. Darüber hinaus kann Threonin-Dehydratasemangel eine nichtketotische Hyperglykinämie verursachen. Threonin -Mangel kann auch neurologische Dysfunktion und Lahmheit verursachen.
Was sind die Ähnlichkeiten zwischen Serin und Threonin?
- Serin und Threonin sind zwei Aminosäuren mit ungeladenen polaren Seitenketten.
- Beide sind proteinogene Aminosäuren.
- Sie bilden kleine Motive wie ST -Kurven, ST -Motiv und Staples, indem sie miteinander interagieren.
- Mangel beider führt zu neurologischen Störungen.
Was ist der Unterschied zwischen Serin und Threonin?
Serin ist eine nicht essentielle Aminosäure, die aus einer α-Amino-Gruppe, einer Carboxylgruppe und einer Seitenkette besteht, die aus einer Hydroxymethylgruppe besteht, während Threonin eine wesentliche Aminosäure ist, die aus einer α-Amino-Gruppe, einer Carboxylgruppe und einer Seite besteht Kette bestehend aus der Hydroxylgruppe. Dies ist also der Hauptunterschied zwischen Serin und Threonin. Darüber hinaus wird Serin durch Codons UCU, UCC, UCA, UCG, AGU und AGC im genetischen Code codiert, während Threonin durch ACU, ACC, ACA und ACG im genetischen Code codiert wird.
Die folgende Infografik listet die Unterschiede zwischen Serin und Threonin in tabellarischer Form für Seite für Seitenvergleich auf.
Zusammenfassung -Serin gegen Threonin
Serin und Threonin sind zwei proteinogene Aminosäuren. Sie sind auch zwei Aminosäuren mit ungeladenen polaren Seitenketten. Serin ist eine nicht essentielle Aminosäure, die sich aus einer α-Amino-Gruppe, einer Carboxylgruppe und einer Seitenkette mit einer Hydroxymethylgruppe zusammensetzt enthält eine Hydroxylgruppe. Dies ist daher der Hauptunterschied zwischen Serin und Threonin.
Referenz:
1. „Serin.”Ein Überblick | Sciencedirect -Themen.
2. „Threonine: Übersicht, Verwendungen, Nebenwirkungen, Vorsichtsmaßnahmen, Interaktionen, Dosierung und Bewertungen.”WebMD.
Bild mit freundlicher Genehmigung:
1. "Serin" (CC BY-SA 3.0) über Commons Wikimedia
2. "L -Threonin - L -Threonin" von Neurotiker - eigene Arbeit (Public Domain) über Commons Wikimedia


