Was ist der Unterschied zwischen Thymolphthalein und Phenolphthalein

Der Schlüsselunterschied zwischen Thymolphthalein und Phenolphthalein ist, dass die Farbänderung des Thymolphthaleins von farblos zu blau auftritt, während die Farbänderung des Phenolphthaleins von farblos zu rosa Farbe auftritt.
Thymolphthalein und Phenolphthalein sind zwei verschiedene pH -Indikatoren, die bei titrimetrischen analytischen Prozessen sehr nützlich sind.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Thymolphthalein
3. Was ist Phenolphthalein
4. Thymolphthalein gegen Phenolphthalein in tabellarischer Form
5. Zusammenfassung -Thymolphthalein gegen Phenolphthalein
Was ist Thymolphthalein?
Thymolphthalein ist eine Art Phthaleinfarbstoff, der als Säure-Base-Indikator nützlich ist. Die chemische Formel von Thymolphthalein ist C28H30O4. Es ist ein pH -Indikator, der seine Farbänderung bei den Änderungen des pH -Werts des Reaktionsgemisches verleiht. Der ÜbergangspH -Bereich dieses Indikators beträgt ungefähr 9.3 - 10.5. Thymolphthalein ist farblos unter pH 9.3, während es in blauen Farbe bei pH -Werten über 10 erscheint.5. Darüber hinaus beträgt der molare Extinktionskoeffizient von Thymolphthalein 38 000 m-1cm-1 bei 595 nm für den blauen Farbindikator Anion.
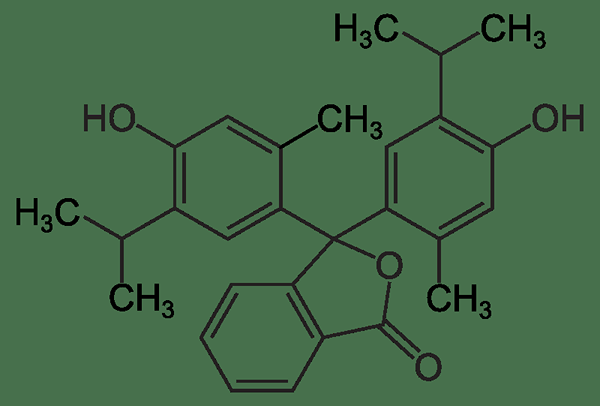
Abbildung 01: Die chemische Struktur des Thymolphthaleinindikators
Die Synthese von Thymolphthalein kann unter Verwendung von Thymol und phthalischem Anhydrid durchgeführt werden. Das Produkt dieser Synthesereaktion ist ein weißes Pulver, das auch die im Handel erhältliche Form von Thymolphthalein ist. Bei hohen Temperaturen zersetzt sich diese Substanz tendenziell. Darüber hinaus wird diese Substanz als Abführmittel und zum Verschwinden von Tinte verwendet.
Was ist Phenolphthalein?
Phenolphthalein ist ein pH-Indikator, der als Säure-Base-Titrationsindikator nützlich ist. Dies ist ein sehr häufiger Indikator, den wir häufig in unseren Labor -Titrationsprozessen verwenden. Die chemische Formel dieser Substanz ist C20H14O4. Wir können diesen Begriff einfach als „hin“ oder als „phph“ schreiben. Die saure Farbe von Phenolphthalein ist farblos, während die grundlegende Farbe von Phenolphthalein rosa ist. Der pH -Bereich für diese Farbänderung beträgt ca. 8.3 - 10.0 Ph.
Darüber hinaus ist der Phenolphthalein-Indikator leicht wasserlöslich und löst sich oft in Alkoholen auf. Auf diese Weise können wir sie leicht in Titrationen verwenden. Phenolphthalein ist eine schwache Säure, die Protonen für die Lösung freisetzen kann. Die saure Form von Phenolphthalein ist nichtionisch und farblos. Die deprotonierte Form von Phenolphthalein ist rosa gefärbt und eine ionische Form. Wenn wir dem Reaktionsgemisch, das aus Phenolphthalein -Indikator besteht.

Abbildung 02: Grundfarbe von Phenolphthalein
In Bezug auf die Synthese des Phenolphthalein -Indikators können wir ihn aus der Kondensation von phthalischem Anhydrid in Gegenwart von zwei Äquivalenten von Phenol unter sauren Bedingungen produzieren. Darüber hinaus kann diese Reaktion mit einer Mischung aus Zinkchlorid und Thionylchlorid katalysiert werden.
Was ist der Unterschied zwischen Thymolphthalein und Phenolphthalein?
Thymolphthalein und Phenolphthalein sind zwei verschiedene pH -Indikatoren, die bei titrimetrischen analytischen Prozessen sehr nützlich sind. Der Schlüsselunterschied zwischen Thymolphthalein und Phenolphthalein besteht darin, dass die Farbänderung von Thymolphthalein von farblos zu blau auftritt, während die Farbänderung des Phenolphthaleins von farblos zu rosa Farbe auftritt. Darüber hinaus beträgt der aktive pH -Bereich von Thymolphthalein 9.3 bis 10.5 Während der aktive pH -Bereich von Phenolphthalein 8 beträgt.3 bis 10.0.
Die folgende Infografik zeigt die Unterschiede zwischen Thymolphthalein und Phenolphthalein in tabellarischer Form für Seite für Seitenvergleich.
Zusammenfassung -Thymolphthalein gegen Phenolphthalein
Thymolphthalein und Phenolphthalein sind zwei verschiedene pH -Indikatoren, die bei titrimetrischen analytischen Prozessen sehr nützlich sind. Der Schlüsselunterschied zwischen Thymolphthalein und Phenolphthalein besteht darin, dass die Farbänderung von Thymolphthalein von farblos zu blau auftritt, während die Farbänderung des Phenolphthaleins von farblos zu rosa Farbe auftritt.
Referenz:
1. „Phenolphthalein.” Nationales Zentrum für Biotechnologie Information. Pubchem Compound -Datenbank, U.S. Nationalbibliothek für Medizin.
Bild mit freundlicher Genehmigung:
1. "Phenolphthalein-at-4-9" von Ben Mills-eigene Arbeit (Public Domain) über Commons Wikimedia
2. "Thymolphthalein" von Neurotiker - eigener Arbeit (Public Domain) über Commons Wikimedia


