Unterschied zwischen 1-Butyne und 2-Butyne
Schlüsselunterschied-1-Butyne gegen 2-Butyne
Alle einfachen aliphatischen Kohlenwasserstoffe werden basierend auf dem Vorhandensein von Einzel- oder Mehrfachbindungen von Kohlenstoff kohlenstofflich in drei Typen eingeteilt: Alkane, Alkene und Alkyne. Alkane sind gesättigte Kohlenwasserstoffe und enthalten nur einzelne Kohlenstoffkohlenstoffbindungen. Die allgemeine Formel von Alkane ist CNH2n+2. Einige gemeinsame Alkane sind Methan, Ethan, Propan und Butan. Alkene sind die unverzweigten ungesättigten Kohlenwasserstoffe mit mindestens einer Carbon-Kohlenstoff-Doppelbindung. Die allgemeine Formel von Alken ist CNH2n. Das einfachste Alken ist Ethylen. Butene, Hexen, Propen sind einige häufige Beispiele für Alkene. Alkine sind die ungesättigten Kohlenwasserstoffe mit mindestens einer Carbon-Kohlenstoff-Dreifachbindung. Die allgemeine Formel von Alkyne ist CNH2n-2. 1-Butyne und 2-Butyne sind zwei einfache Alkinne, die eine Carbon-Kohlenstoff-Dreifachbindung an verschiedenen Stellen enthalten. Beide haben die gleiche molekulare Formel von C4H6, haben aber einige Unterschiede. Der Schlüsselunterschied zwischen 1-Butyne und 2-Butyne ist das In 1-Butyen wird die Dreifachbindung zwischen dem ersten und dem zweiten Kohlenstoff gefunden, während sie in 2-Butyen zwischen dem zweiten und dritten Kohlenstoffatomen gefunden wird. Aus diesem Unterschied haben diese beiden Substanzen völlig unterschiedliche charakteristische Merkmale.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist 1-Butyne
3. Was ist 2-Butyne
4. Seite für Seitenvergleich-1-Butyne gegen 2-Butyne in tabellarischer Form
5. Zusammenfassung
Was ist 1-Butyne?
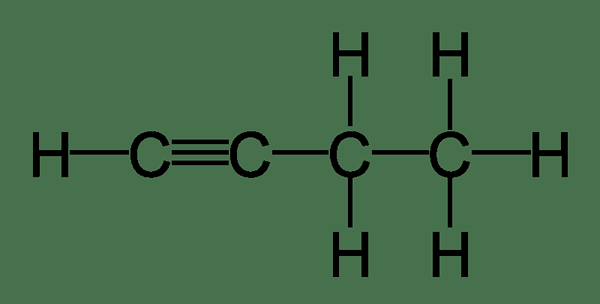
1-Butyne wird aufgrund des Vorhandenseins einer terminalen Dreifachbindung zwischen dem ersten und zweiten Kohlenstoffatomen der Kohlenstoffkette ein terminales Alkin bezeichnet. Aufgrund des Vorhandenseins dieser terminalen Bindung kann 1-Butyne durch zwei Haupttests von 2-Butyen unterschieden werden. Im ersten Test ergibt die ammoniakalische Kupferchloridlösung einen roten Niederschlag mit 1-Butyin, was zu Kupfer 1-Butynid führt. Im zweiten Test reagiert die ammoniakalische Silbernitratlösung mit 1-Butyne, was zu Silber 1-Butynid führt, was ein weißer Niederschlag ist. Beide beiden Lösungen reagieren nicht mit 2-Butyne.

Abbildung 01: 1-Butyne
1-Butyne ist ein extrem brennbares farbloses Gas. Es ist dicht als normale Luft. Der IUPAC-Name von 1-Butyne ist aber 1-1-yne.
Was ist 2-Butyne?
2-Butyne ist ein nicht terminales Alky. Im Gegensatz zu terminalen Alkinen reagieren 2-Butyne weder mit ammoniakaler Kupferchloridlösung noch mit ammoniakaler Silbernitratlösung, um charakteristische Niederschläge zu ergeben. Die terminalen Alkylgruppen von 2-Butyne liefern Elektronen für SP-hybridisierte Kohlenstoff, wodurch das Alkyen stabilisiert und gleich. Daher ist die Hydrierungswärme in 2-Butyne weniger als bei 1-Butyne. 2-Butyne ist eine farblose Flüssigkeit und emittiert einen Erdöl-ähnlichen Geruch. Es hat eine niedrige Dichte als Wasser und ist in Wasser nicht löslich. Der IUPAC-Name ist aber 2-yne.

Abbildung 02: 2-Butyne
Was ist der Unterschied zwischen 1-Butyne und 2-Butyne?
1-Butyne gegen 2-Butyne | |
| 1-Butyne ist ein terminales Alkin mit einer dreifachen Bindung, die den ersten und zweiten Kohlenstoffatomen verbindet. | 2-Butyne ist ein nicht terminales Alkin mit einer dreifachen Bindung, die den zweiten und dritten Kohlenstoffatomen verbindet. |
| Hydrierungswärme | |
| Wärme der Hydrierung beträgt 292 kJ/mol. | Hydrierungswärmeist 275 kJ/mol. |
| Phase | |
| 1-Butyne ist ein farbloses Gas. | 2-Butyne ist eine farblose Flüssigkeit. |
| Stabilität | |
| 1-Butyne ist aufgrund des Vorhandenseins einer Triple-Bindung weniger stabil als 2-Butyne. | 2-Butyne ist stabiler. |
| Mit ammoniakaler Cupro -Chloridlösung | |
| 1-Butyne gibt einen roten Niederschlag von Kupfer 1-Butynid. | 2-Butyne gibt keinen solchen Niederschlag. |
| Mit ammoniakaler Silbernitratlösung (Tollens Reagenz) | |
| 1-Butyne gibt einen weißen Niederschlag von Silberacetylid. | 2-Butyne gibt keinen solchen Niederschlag. |
| IUPAC -Name | |
| IUPAC-Name ist aber-1-yne. | IUPAC-Name ist aber 2-yne. |
| Gemeinsamen Namen | |
| Der gebräuchliche Name ist Ethylacetylen. | Der gebräuchliche Name ist Dimethylacetylen. |
Zusammenfassung-1-Butyne gegen 2-Butyne
Sowohl 1-Butyne als auch 2-Butyne sind Kohlenwasserstoffe, die zur Gruppe der Alkine gehören. 1-Butyne ist ein terminales Alkin mit einer dreifachen Bindung, die C1 und C2 verbindet. Es ist ein farbloses Gas. 2-Butyne ist eine farblose Flüssigkeit, die seine dreifache Bindung mit C2- und C3-Atomen verbindet. Daher ist 2-Butyne ein nicht terminales Alkin. Aufgrund dieses Unterschieds zwischen 1-Butyne und 2-Butyne haben diese beiden Kohlenwasserstoffe völlig unterschiedliche chemische und physikalische Eigenschaften. Ihre chemische Formel ist jedoch die gleiche, ich.e., C4H6.
Laden Sie die PDF-Version von 1-Butyne gegen 2-Butyne herunter
Sie können die PDF -Version dieses Artikels herunterladen und ihn für Offline -Zwecke gemäß Citation Note verwenden. Bitte laden Sie die PDF-Version hier den Unterschied zwischen 1-Butyne und 2-Butyne herunter
Verweise:
1. Carey, Francis a., und Richard J. Sundberg. Fortgeschrittene organische Chemie Teil A: Struktur und Mechanismen. Boston, MA, Springer US, 2007.
2. Lon, Clive. X-Kit FET Grade 12 Phys Science Chemistry. Südafrika, Pearson, 2008.
3. „1-Butyne.Nationales Zentrum für Biotechnologieinformationen. Pubchem Compound -Datenbank, u.S. National Library of Medicine, hier verfügbar. Zugriff am 8. September. 2017.
4. “2-Butyne.Nationales Zentrum für Biotechnologieinformationen. Pubchem Compound -Datenbank, u.S. National Library of Medicine, hier verfügbar. Zugriff am 8. September. 2017.
Bild mit freundlicher Genehmigung:
1. "Ethylacetylen" von Magmar452 - eigene Arbeit (CC0) über Commons Wikimedia
2. "Dimethylacetylene" von Edgar181 - eigene Arbeit (Public Domain) über Commons Wikimedia


