Unterschied zwischen Säure und Base
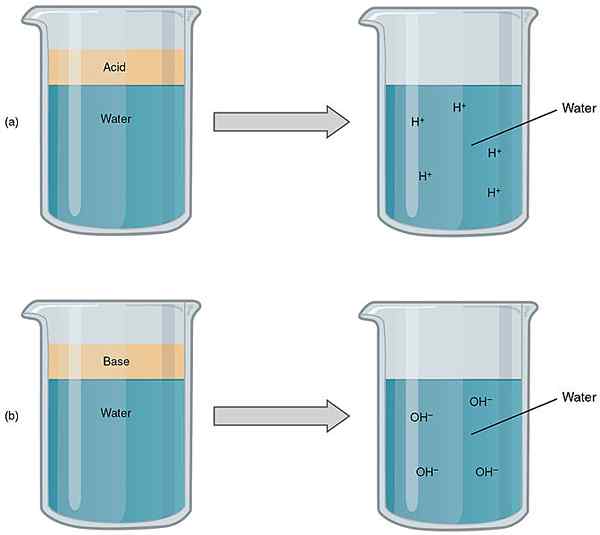
Der Schlüsselunterschied zwischen Säure und Base ist das Säuren haben pH -Werte im Bereich von 1 bis 7, während Basen pH -Werte von 7 bis 14 haben.
Der pH -Wert ist der Minus -Logarithmus von H+ Ionenkonzentration. pH 7 wird als neutraler pH -Wert angesehen. pH -Werte höher als 7 geben das Vorhandensein einer Base an, während die Werte unter 7 das Vorhandensein von Säuren anzeigen. Nach der Brønsted-Lowry-Theorie können Säuren H freisetzen+ Ionen, während Basen h akzeptieren können h+ Ionen.

INHALT
1. Überblick und wichtiger Unterschied
2. Was ist eine Säure
3. Was ist eine Basis
4. Seite an Seite Vergleich - Säure gegen Base in tabellarischer Form
5. Zusammenfassung
Was ist eine Säure?
Säuren sind Substanzen mit einem pH -Wert von weniger als 7 in ihrer wässrigen Lösung. Das Vorhandensein eines sauren Mediums kann unter Verwendung von Lackmustapern bestimmt werden. Säuren können blaue Lackmus rot werden. Es gibt jedoch keine Farbänderung, wenn roter Lackmus verwendet wird. Verbindungen mit leicht ionisierbaren Wasserstoffatomen sind häufig Säuren.
Nach der Brønsted-Lowry-Theorie ist eine Säure eine Substanz, die Protonen freisetzen kann (H+ Ionen) zum Medium, wenn es in einem wässrigen Medium ist. Wenn H+ Ionen werden freigesetzt, diese Ionen können nicht allein im wässrigen Medium existieren. Daher verbinden sich diese Ionen mit Wassermolekülen und bilden H3Ö+ Ionen (Hydroniumionen). Das Vorhandensein von Hydroniumionen zeigt somit das Vorhandensein einer Säure an.
Nach der Arrhenius -Theorie ist eine Säure eine Substanz, die die Menge an Hydroniumionen in einem wässrigen Medium erhöhen kann. Dies geschieht aufgrund der Zunahme von H+ Ionen. Mit anderen Worten, Säuren füllen h frei+ Ionen, die mit Wassermolekülen interagieren können, um Hydroniumionen zu bilden.
Bei der Betrachtung der Lewis -Theorie ist eine Säure eine Verbindung, die ein Elektronenpaar aus einer kovalenten chemischen Bindung akzeptieren kann. Basierend auf dieser Definition werden Substanzen mit keinen Wasserstoffatomen aufgrund ihrer Fähigkeit, Elektronenpaare zu akzeptieren, als Säuren kategorisiert.
Eigenschaften einer Säure
Eine Säure hat typischerweise einen sauren Geschmack. Der pH -Wert einer Säure ist immer weniger als 7. Fast alle Säuren haben einen brennenden Geruch. Die Textur einer Säure ist eher klebrig als rutschig. Darüber hinaus können Säuren mit Metallen (sogar sehr nicht respektive Metalle) reagieren, um Metallhydrid und Wasserstoffgas zu bilden.
Was ist eine Basis?
Eine Basis ist eine Substanz, die einen pH -Wert von höher als 7 zeigt, wenn sie sich in einer wässrigen Lösung befindet. Die Basizität einer Lösung bewirkt, dass die Farbe des roten Lackmus in blaue Farbe wird. Daher kann das Vorhandensein einer Basis unter Verwendung des roten Lackmus bestimmt werden. Wenn jedoch blaue Lackmus verwendet wird, gibt es keine Farbänderung mit einer Basis. Verbindungen mit leicht ionisierbaren Hydroxylgruppen sind häufig Basen.
Nach der Brønsted-Lowry-Theorie ist eine Basis ein Protonenakzeptor; Mit anderen Worten, eine Basis kann Protonen aus einem wässrigen Medium akzeptieren. Die Arrhenius -Theorie gibt jedoch auch eine ähnliche Definition an: Eine Basis ist eine Substanz, die die Menge der in einem Medium vorhandenen Hydroniumionen verringert. Die Hydroniumionenkonzentration wird verringert, da die Basis H erhält+ Ionen oder Protonen aus dem wässrigen Medium. Diese Ionen werden für die Bildung von Hydroniumionen benötigt.

Abbildung 1: Vergleich von Säuren und Basen
Bei der Betrachtung der Lewis -Theorie ist eine Basis eine Substanz, die Elektronenpaare spenden kann. Diese Substanzen spenden Elektronenpaare und form kovalische Bindungen. Nach dieser Theorie werden die meisten Verbindungen, die keine OH-Gruppen haben.
Eigenschaften einer Basis
Basen haben einen bitteren Geschmack. Diese Substanzen zeigen immer pH -Werte höher als 7. Fast alle Basen sind geruchlos, bis auf Ammoniak. Ammoniak hat einen scharfen Geruch. Im Gegensatz zu Säuren fühlen sich Basen rutschig an. Basen werden neutralisiert, wenn sie mit Säuren reagiert werden.
Was ist der Unterschied zwischen Säure und Base?
Säure gegen Basis | |
| Eine Säure ist eine Substanz, die einen pH -Wert von weniger als 7 zeigt, wenn sie sich in einer wässrigen Lösung befindet | Eine Basis ist eine Substanz, die einen pH -Wert höher als 7 zeigt, wenn sie sich in einer wässrigen Lösung befindet |
| Definition basierend auf der Brønsted-Lowry-Theorie | |
| Eine Säure ist eine Substanz, die Protonen (H+ -Ionen) auf das Medium freisetzen kann, wenn sie sich in einem wässrigen Medium befindet. | Eine Basis ist ein Protonenakzeptor; Mit anderen Worten, eine Basis kann Protonen aus einem wässrigen Medium akzeptieren. |
| Definition basierend auf der Arrhenius -Theorie | |
| Eine Säure ist eine Substanz, die die Menge an Hydroniumionen in einem wässrigen Medium erhöhen kann. | Eine Basis ist eine Substanz, die die Menge an Hydroniumionen in einem wässrigen Medium verringern kann. |
| Definition basierend auf der Lewis -Theorie | |
| Eine Säure ist eine Verbindung, die in der Lage ist, ein Elektronenpaar aus einer kovalenten chemischen Bindung zu akzeptieren. | Eine Basis ist eine Substanz, die Elektronenpaare spenden kann. |
| Farbwechsel im Lackmus | |
| Säuren können blaue Lackmus rot werden, aber es gibt keine Farbänderung in roten Lackmus. | Basen können rote Lackmus blau werden, aber es gibt keine Farbwechslung im blauen Lackmus. |
| Schmecken | |
| AIDS haben einen sauren Geschmack. | Basen haben einen bitteren Geschmack. |
| Geruch | |
| Säuren haben einen brennenden Geruch. | Basen sind geruchlos, bis auf Ammoniak. |
| Ionisation | |
| Säuren können bei ionisierten Hydroniumionen bilden. | Basen können bei ionisierten Hydroxylionen bilden. |
| Konjugierte chemische Spezies | |
| Die konjugierte Spezies einer Säure ist ihre konjugierte Base. | Die konjugierte Spezies einer Base ist ihre Konjugatsäure. |
| Neutralisation | |
| Eine Säure kann mit einer Base neutralisiert werden. | Eine Base kann mit einer Säure neutralisiert werden. |
| Titration | |
| Säuren werden mit Basen für die Neutralisation titriert. | Basen werden mit Säuren für die Neutralisation reagiert. |
Zusammenfassung - Säure gegen Basis
Alle Verbindungen können in Säuren, Basen und neutrale Verbindungen kategorisiert werden. Der Schlüsselunterschied zwischen Säure und Base besteht darin, dass Säuren pH -Werte von 1 bis 7 haben, während Basen pH -Werte von 7 bis 14 haben.
Referenz:
1. Helmenstine, Anne Marie. „Hier ist, was eine Säure in der Chemie ist.”Thoughtco, hier erhältlich.
2. Helmenstine, Anne Marie. „Schlüsselsäuren und Basendefinitionen.”Thoughtco, hier erhältlich.
3. Libretexten. „Überblick über Säuren und Basen.”Chemistry Libretexten, Libretexte, 13. Februar. 2017, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "215 Säuren und Basen -01" von OpenStax College - Anatomy & Physiology, Connexions -Website, 19. Juni 2013 (CC von 3.0) über Commons Wikimedia


