Differenz zwischen Säurisonisationskonstante und Basenionisationskonstante
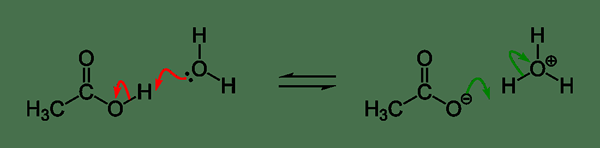
Schlüsselunterschied - Säureionisation Konstante vs Basiionenionisationskonstante
Die Säureionisationskonstante (KA, auch als Säure -Dissoziationskonstante bezeichnet) ergibt die quantitative Messung des zwischen Säuremolekülen und ihren ionisierten Formen bestehenden Gleichgewichts. In ähnlicher Weise ergibt die Basenionisationskonstante (KB oder Basendissoziationskonstante) die quantitative Messung des zwischen den Basenmolekülen und ihren ionisierten Formen bestehenden Gleichgewichts. Der Schlüsselunterschied zwischen der Säureionisationskonstante und der Basenionisationskonstante ist das Die Säureionenkonstante ergibt ein quantitatives Maß für die Stärke einer Säure in einer Lösung, während die Basiionenionisationskonstante ein quantitatives Maß für die Stärke einer Base in einer Lösung ergibt.
Ionisation ist die Trennung von Molekülen in ionische Spezies (Kationen und Anionen). Die Gleichgewichtskonstante ist die Beziehung zwischen den Mengen von Reaktanten und Produkten, die sich im Gleichgewicht miteinander befinden.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Säureionisationskonstante
3. Was ist die Basiionen -Ionisationskonstante
4. Seite für Seitenvergleich - Säureionisationskonstante gegen Basenionisationskonstante in tabellarischer Form
5. Zusammenfassung
Was ist Säureionisationskonstante?
Säureionisationskonstante ist die Zahl, die die Beziehung zwischen Säuremolekülen und den ionischen Spezies ausdrückt, die in derselben Lösung existieren. Die Säure -Dissoziationskonstante wird durch KA gekennzeichnet. Es ist ein quantitatives Maß für die Stärke einer Säure in einer Lösung. Die Stärke einer Säure hängt von der Ionisierung (oder Dissoziation) einer Säure in einer wässrigen Lösung ab.
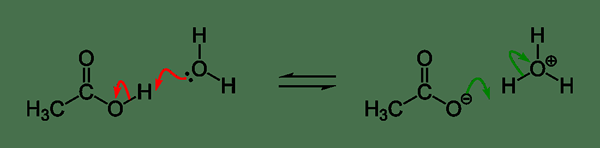
Abbildung 01: Ein Beispiel für die Säureionisierung
Die Ionisierung einer Säure kann wie unten angegeben werden,
Ha + h2O ↔ a- + H3Ö+
In diesem Fall ist HA eine schwache Säure, die teilweise zu Ionen dissoziiert; Anion ist als konjugierte Base dieser besonderen Säure bekannt. Die Dissoziation der Säure füllt ein Proton (Wasserstoffionen; H+). Dieses Proton kombiniert mit einem Wassermolekül, das ein Hydroniumionen bildet (H)3Ö+). Die Säureionisationskonstante dieser HA -Säure kann wie unten angegeben werden,
Ka = [a-][ H3Ö+] / [Ha] [h2Ö]
Die gemeinsame Form von kA ist PKA, das ist der minus logarithmische Wert von Ka. Das liegt daran, dass die KA -Werte sehr kleine Werte sind und schwer zu handhaben sind. Die PKA gibt eine einfache Zahl, mit der einfach zu handhaben ist. Es kann wie unten angegeben werden,
pka = -log (ka)
Die KA- oder PKA -Werte können verwendet werden, um die Stärke einer Säure auszudrücken.
- Schwache Säuren haben niedrigere KA -Werte und höhere PKA -Werte
- Starke Säuren haben höhere KA -Werte und niedrigere PKA -Werte.
Was ist die Basiionen -Ionisationskonstante?
Die Basiionen -Ionisationskonstante ist die Zahl, die die Beziehung zwischen Basenmolekülen und den ionischen Spezies in derselben Lösung exprimiert. Dies wird mit KB bezeichnet. Es misst die Stärke einer Basis in einer Lösung. Höher der KB, höher die Ionisierung der Basis. Für eine bestimmte Basis in einer Lösung kann die Basisdissoziationskonstante wie unten angegeben werden,
B+ h2O ↔ bh+ + OH-
Kb = [bh+][OH-] / [B] [h2Ö]
Da die KB -Werte von Basen sehr kleine Werte sind, wird der Minus -Protokollwert von KB stattdessen KB verwendet. Der Minus -Protokollwert von KB wird mit PKB bezeichnet. PKB gibt eine Zahl, die leicht zu handhaben ist.
PKB = -Log (KB)
Die Stärke einer Basis kann durch KB -Werte oder PKB -Werte wie folgt ausgedrückt werden.
- Höher der Wert der Basenionisationskonstante, stärker die Basis (senken Sie die PKB)
- Senken Sie den Wert der Basenionisationskonstante, schwächer die Basis (höher der PKB)
Was ist der Unterschied zwischen der Säureionisationskonstante und der Basenionisationskonstante?
Säureionisationskonstante gegen Basiionenionisationskonstante | |
| Säureionisationskonstante ist die Zahl, die die Beziehung zwischen Säuremolekülen und den in derselben Lösung existierenden ionischen Spezies ausdrückt. | Die Basiionen -Ionisationskonstante ist die Zahl, die die Beziehung zwischen Basenmolekülen und den in derselben Lösung existierenden ionischen Spezies ausdrückt. |
| Konzept | |
| Die Säureionenkonstante ergibt die Stärke einer Säure. | Basiionenionisationskonstante gibt die Stärke einer Basis an. |
| Protokollwert | |
| Der Minus -Protokollwert von KA ist PKA. | Der Minus -Protokollwert von KB ist PKB. |
| Wert der Konstante | |
| Schwache Säuren haben niedrigere KA -Werte und höhere PKA -Werte, während starke Säuren höhere KA -Werte und niedrigere PKA -Werte aufweisen. | Schwache Basen haben niedrigere KB -Werte und höhere PKB -Werte, während starke Basen höhere KB -Werte und niedrigere PKB -Werte aufweisen. |
Zusammenfassung - Säureionisation Konstante vs Basiionenionisationskonstante
Säureionisationskonstante und Basenionisationskonstante sind Messungen der Säure- bzw. Basenstärke. Die Differenz zwischen der Säureionisationskonstante und der Basenionisationskonstante besteht darin, dass die Säureionisationskonstante ein quantitatives Maß für die Stärke einer Säure in einer Lösung ergibt, während die Basiionenionisationskonstante ein quantitatives Maß für die Stärke einer Base in einer Lösung ergibt.
Referenz:
1.„16.4: Säurestärke und Säure -Dissoziationskonstante (KA).”Chemistry Libretexten, Libretexte, 26. Februar. 2017. Hier verfügbar
2.„Starke und schwache Basen und Basenionisationskonstante (KB).”CK-12 Foundation, CK-12 Foundation, 11. September. 2016. Hier verfügbar
3.„Säuren und Basen: Ionisationskonstanten.Ionisation von Säuren und Basen. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Essigsäure-Dissoziation-2D-curly-arrows'By Ben Mills-eigene Arbeit, (Public Domain) über Commons Wikimedia


