Unterschied zwischen Actinides und Lanthaniden
Der Schlüsselunterschied Zwischen Actinides und Lanthaniden ist das die Actinide füllen Elektronen zu 5F-Suborbitalen, während Lanthanide Elektronen bis zu 4 F-Suborbitalen füllen.
Lanthanide und Actinide treten in zwei getrennten Zeilen in der Periodenzüchttabelle auf. Daher gehören beide zum F -Block. Es ist, weil sie ihre äußersten Elektronen in F -Orbitalen haben. Daher können wir sie als F -Blockelemente benennen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Actinides
3. Was sind Lanthanides
4. Seite an Seitenvergleich - Actinides gegen Lanthanide in tabellarischer Form
5. Zusammenfassung
Was sind Actinides?
Actinides ist eine Reihe von Elementen in der Periodenzüchttabelle mit den Atomzahlen von 90 bis 103. Dementsprechend gibt es 14 Metallelemente, darunter die Anhängerschaft:
- Thorium tH (z = 90)
- Protaktinium PA (91)
- URANIUM U (92)
- Neptunium NP (93)
- Plutonium pu (94)
- Americium AM (95)
- Curium cm (96)
- Berkelium BK (97)
- Kalifornien CF (98)
- Einsteinium ES (99)
- Fermium FM (100)
- MDELEVIUM MD (101)
- eine Einheit ї 102
- Lawrencium LR (103).
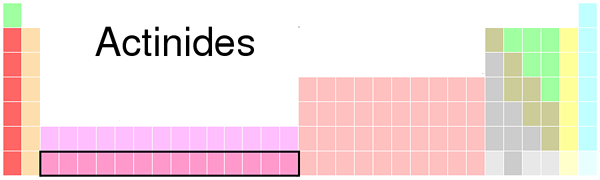
Wir nennen sie als F -Blockelemente; Weil ihre endgültigen Elektronen in einem F-Suborbital liegen. Alle Aktinide sind instabil; Daher sind alle radioaktiv. Da es sich um Metalle handelt, sind sie sehr elektropositiv. Darüber hinaus sind sie dichte Metalle, und es sind zahlreiche Allotrope vorhanden. Diese Metalle sterben leicht in der Luft und reagieren mit kochendem Wasser oder verdünnten Säure, wobei Wasserstoffgas freigesetzt wird.

Abbildung 01: Aktinidort in der Periodenzüchtertabelle
Wie andere Metalle können sie auch Verbindungen mit Nichtmetallelementen bilden. Darüber hinaus können wir Actinides in der natürlichen Umgebung finden, obwohl einige sehr selten sind. Zum Beispiel sind Uranium und Thorium als Ablagerungen in Kanada vorhanden. Aufgrund ihrer Radioaktivität sind die meisten Actinide in der Kernenergieproduktion nützlich. Wir können Actinidelemente synthetisch produzieren, um sie für verschiedene Zwecke zu verwenden. Abgesehen davon sind einige von ihnen nützlich für medizinische Zwecke, Mineralidentifikation, Neutronenradiographie usw.
Was sind Lanthanides?
Lanthanides enthalten Elemente von Atomzahl 57 bis 71. Es gibt 15 metallische Elemente. Diese Elemente umfassen die Anhängerschaft:
- Lanthanum LA (57)
- Cerium CE (58)
- Praseodym PR (59)
- Neodym ND (60)
- Promethium PM (61)
- Samarium SM (62)
- EU EU (63) Europium EU
- Gadolinium GD (64)
- Terbium TB (65)
- Dyprosium DY (66)
- Holmium Ho (67)
- Yttrium ER (68)
- Thulium TM (69)
- ytterbium yb (70)
- Lutetium Lu (71).
Diese gehören zum F -Block in der Periodenzüchter; Daher füllen sich endgültige Elektronen in das 4F-Suborbital. Dort decken andere Suborbitale die 4F-Orbitale ab, und die Chemie von Lanthaniden unterscheidet sich aufgrund der Größe des Atoms. Sie zeigen +3 Oxidationszustand. Darüber hinaus nimmt die Größe von +3 Lanthanidionen von links nach rechts in einer Reihe in der Periodenzüchttabelle ab, und wir nennen dies als Lanthanidkontraktion.
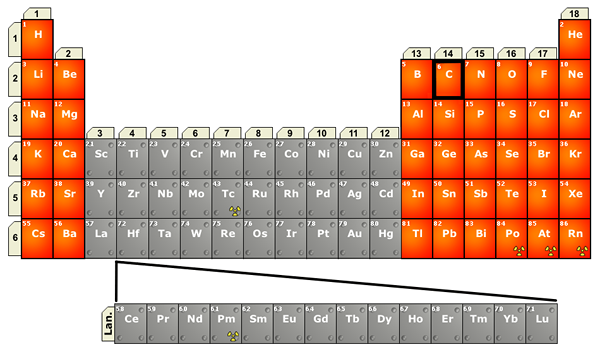
Abbildung 02: Position von Lanthaniden in der Periodenzüchtertabelle
Darüber hinaus sind Lanthanide Silberfarbenmetalle, die leicht mit Sauerstoff in der Luft reagieren, um ihre Oxide zu produzieren. Dies sind hochreaktive, relativ weiche Metalle mit hohen Schmelzpunkten und Siedepunkten. Außerdem bilden sie leicht ionische Verbindungen mit Nichtmetallen. Bei der Reaktion mit verdünnten Säure oder Wasserlanthaniden produzieren Wasserstoffgas.
Abgesehen davon haben diese Elemente ungepaarte Elektronen (außer Lutetium), die für ihre paramagnetischen Eigenschaften verantwortlich sind. Darüber hinaus nennen wir sie aufgrund der geringen Häufigkeit auf der Erdoberfläche als Seltenerdmetalle. Obwohl sie selten sind, gibt es viele Verwendungen von diesen Elementen. Daher sind sie als Katalysatoren in der Glasproduktion, im Erdöl usw. nützlich. Darüber hinaus sind sie nützlich in Magneten, Phosphoren, Lampen, Supraleitern, optoelektronischen Anwendungen usw.
Was ist der Unterschied zwischen Actinides und Lanthaniden?
Actinides ist eine Reihe von Elementen in der Periodenzüchttabelle mit den Atomnummern von 90 bis 103, während Lanthanides eine Reihe von Elementen in der Periodenzüchter mit Atomnummern 57 bis 71 ist. Der Hauptunterschied zwischen Actiniden und Lanthaniden besteht darin, dass die Actinide Elektronen zu 5F-Suborbitalen füllen, während die Lanthaniden Elektronen bis zu 4F-Suborbitalen füllen. Darüber hinaus sind alle Actinides radioaktiv, aber Lanthanide sind nicht (außer Promethium). Als ein weiterer Unterschied zwischen Actiniden und Lanthaniden können wir sagen, dass die Lanthanide einen maximalen Oxidationszustand +4 zeigen, während die Actinide +3, +4, +5, +6 und +7 Oxidationszustände zeigen.
Nach der Infografik stellt eine Vergleichsübersicht des Unterschieds zwischen Actinides und Lanthaniden vor.

Zusammenfassung -Actinides gegen Lanthanides
Actinides ist eine Reihe von Elementen in der Periodenzüchttabelle mit den Atomnummern von 90 bis 103, während Lanthanides eine Reihe von Elementen in der Periodenzüchter mit Atomnummern 57 bis 71 ist. Daher besteht ihr Hauptunterschied in ihrer Elektronenkonfiguration. Daher besteht der Hauptunterschied zwischen Aktiniden und Lanthaniden darin, dass Actinide Elektronen zu 5F-Suborbitalen füllen, während Lanthanide Elektronen bis zu 4 ° F Suborbitalen füllen.
Referenz:
1. Libretexten. „Lanthanide: Eigenschaften und Reaktionen.”Chemistry Libretexten, National Science Foundation, 26. November. 2018. Hier verfügbar
2. Libretexten. „Die Actinides.”Chemistry Libretexten, National Science Foundation, 26. November. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.”Actinid-table” (CC BY-SA 3.0) über Commons Wikimedia
2.”Orgchem maingrp metals von interessierenddps.0) über Commons Wikimedia


