Unterschied zwischen adiabatisch und isothermisch
Der Schlüsselunterschied zwischen adiabatisch und isotherm ist das Adiabatische Mittel haben keinen Wärmeaustausch zwischen dem System und der Umgebung, während isotherme bedeutet, dass keine Temperaturänderung vorliegt.
Für den Zweck der Chemie ist das Universum in zwei Teile unterteilt. Der Teil, an dem wir interessiert sind, wird als System bezeichnet und der Rest wird als Umgebung bezeichnet. Ein System kann ein Organismus, ein Reaktionsgefäß oder sogar eine einzelne Zelle sein. Die Systeme unterscheiden sich durch die Art der Interaktionen, die sie haben, oder durch die Arten von Austauschern, die stattfinden.
Systeme können in zwei als offene Systeme und geschlossene Systeme eingeteilt werden. Manchmal können Angelegenheiten und Energie durch die Systemgrenzen ausgetauscht werden. Die ausgetauschte Energie kann verschiedene Formen wie Lichtenergie, Wärmeenergie, Schallenergie usw. annehmen. Wenn sich die Energie eines Systems aufgrund eines Temperaturunterschieds ändert, sagen wir, dass es einen Wärmefluss gab. Adiabatische und polytropische sind zwei thermodynamische Prozesse, die mit dem Wärmeübertragung in Systemen zusammenhängen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist adiabatisch
3. Was ist isotherm
4. Seite an Seitenvergleich - adiabatische vs isotherme in tabellarischer Form
5. Zusammenfassung
Was ist adiabatisch?
Adiabatische Veränderung ist eine Änderung, bei der keine Wärme in oder aus dem System übertragen wird. Die Wärmeübertragung kann hauptsächlich auf zwei Arten gestoppt werden. Eine wird durch die Verwendung einer thermisch isolierten Grenze verwendet, damit keine Wärme eintreten oder ausgehen kann. Zum Beispiel ist eine Reaktion in einem Dewar -Kolben adiabatisch. Die andere Art des adiabatischen Prozesses tritt auf, wenn ein Prozess sehr schnell stattfindet. Daher bleibt keine Zeit mehr, die Wärme ein- und auszusteigen.
In der Thermodynamik werden adiabatische Änderungen durch DQ = 0 gezeigt. In diesen Fällen besteht eine Beziehung zwischen Druck und Temperatur. Daher unterliegt das System aufgrund des Drucks unter adiabatischen Bedingungen Veränderungen. Dies geschieht in der Cloud -Bildung und in großen Konvektionsströmen. In höheren Höhen gibt es einen geringeren atmosphärischen Druck. Wenn die Luft erhitzt wird, neigt sie dazu, nach oben zu gehen. Da der Luftdruck von außen niedrig ist, wird das steigende Luftpaket versuchen, sich zu erweitern. Bei der Erweiterung funktionieren die Luftmoleküle und dies wirkt sich auf ihre Temperatur aus. Deshalb reduziert sich die Temperatur beim Aufstieg.
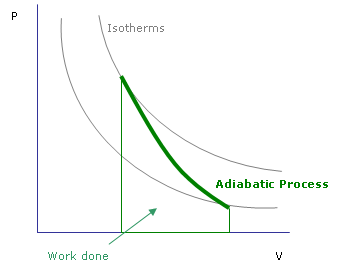
Abbildung 01: Adiabatischer Prozess
Nach der Thermodynamik bleibt die Energie im Paket konstant, kann aber umgewandelt werden, um die Expansionsarbeit zu erledigen oder um ihre Temperatur aufrechtzuerhalten. Es gibt keinen Wärmeaustausch mit außen. Das gleiche Phänomen kann auch auf die Luftkomprimierung angewendet werden (e.G.: ein Kolben). In dieser Situation erhöht sich das Luftpaket die Temperatur. Diese Prozesse werden als adiabatische Erwärmung und Kühlung bezeichnet.
Was ist isotherm
Die isotherme Veränderung ist diejenige, bei der das System bei einer konstanten Temperatur bleibt. Daher ist dt = 0. Ein Prozess kann isotherm sein, wenn es sehr langsam auftritt und wenn der Prozess reversibel ist. So dass die Änderung sehr langsam auftritt, es ist genügend Zeit, um die Temperaturschwankungen anzupassen. Wenn ein System wie ein Kühlkörper wirken kann, wo es nach der Absorption von Wärme eine konstante Temperatur aufrechterhalten kann, ist es ein isothermes System.

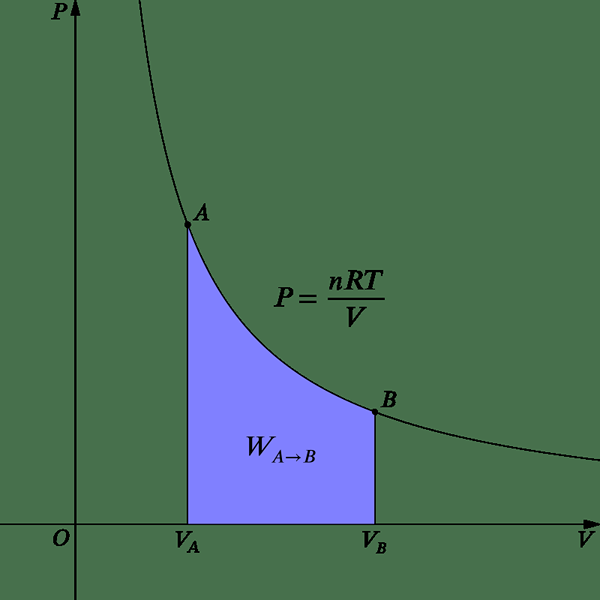
Abbildung 2: isotherme Veränderung
Für ein Ideal unter isothermen Bedingungen kann der Druck aus der folgenden Gleichung angegeben werden.
P = nrt /v
Seit der Arbeit, W = PDV Die folgende Gleichung kann abgeleitet werden.
W = nrt ln (vf/vi)
Daher tritt bei konstanter Temperatur die Expansions- oder Komprimierungsarbeit auf, während das Systemvolumen geändert wird. Da es keine interne Energieänderung in einem isothermen Prozess (du = 0) gibt. Das passiert in einem Wärmemotor.
Was ist der Unterschied zwischen adiabatisch und isothermisch?
Adiabatische Mittel haben keinen Wärmeaustausch zwischen dem System und der Umgebung. Daher steigt die Temperatur, wenn es sich um eine Komprimierung handelt, oder die Temperatur nimmt die Expansion ab. Im Gegensatz dazu gibt es keine isothermen Mittel, es gibt keine Temperaturänderung. Somit ist die Temperatur in einem System konstant. Dies wird erworben, indem die Hitze geändert wird. In adiabatischer DQ = 0, aber dt ≠ 0. In isothermen Änderungen dt = 0 und dq ≠ 0 jedoch in isothermen Veränderungen. Dies ist also der Hauptunterschied zwischen adiabatisch und isothermisch. Darüber hinaus erfolgen die adiabatischen Veränderungen schnell, während die isothermen Veränderungen sehr langsam stattfinden.
Nachfolgend info-grafisch fasst die Unterschiede zwischen adiabatisch und isothermisch zusammen.
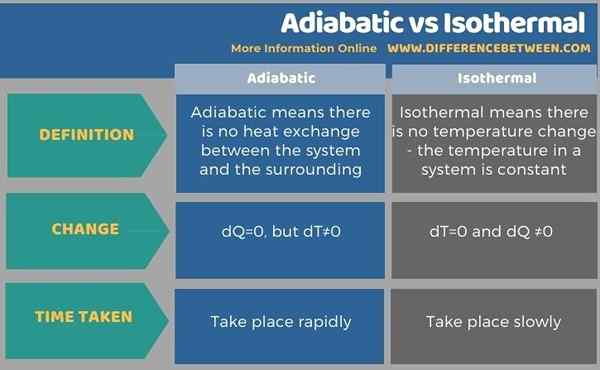
Zusammenfassung -adiabatische gegen isotherme
Der wichtigste Unterschied zwischen adiabatisch und isotherm ist, dass adiabatischer Mittel bedeutet, dass zwischen dem System und der Umgebung kein Wärmeaustausch besteht.
Bild mit freundlicher Genehmigung:
1. "Adiabatisch" (CC BY-SA 3.0) über Commons Wikimedia
2. "Isothermalprozess" von Netheril96 - eigener Arbeit (CC0) über Commons Wikimedia


