Unterschied zwischen Alkanen und Alkenen
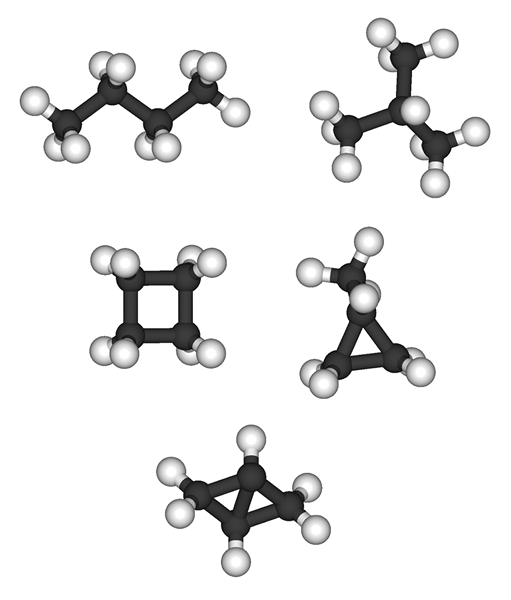
Schlüsselunterschied - Alkane gegen Alkene
Alkane und Alkene sind zwei Arten von Kohlenwasserstofffamilien, die Kohlenstoff und Wasserstoff in ihrer molekularen Struktur enthalten. Der Hauptunterschied zwischen Alkanen und Alkenen ist ihre chemische Struktur; Alkane sind gesättigte Kohlenwasserstoffe mit der allgemeinen molekularen Formel von CNH2n+2 und Alkene sollen eine ungesättigte Kohlenwasserstoffgruppe sind, da sie eine Doppelbindung zwischen zwei Kohlenstoffatomen enthalten. Sie haben die allgemeine molekulare Formel von CNH2n.
Was sind Alkane?
Alkane enthalten nur einzelne Bindungen zwischen Kohlenstoff- und Wasserstoffatomen (C-C-Bindungen und C-H-Bindungen). Daher werden sie als "gesättigte Kohlenwasserstoffe" bezeichnet. Nach dem Orbitalhybridisierungsmodell haben alle Kohlenstoffatome in Alkenen den SP3 Hybridisierung. Sie bilden Sigma -Bindungen mit Wasserstoffatomen, und das resultierende Molekül hat die Geometrie eines Tetraeders. Alkane können gemäß ihren molekularen Anordnungen in zwei Gruppen unterteilt werden. acyclische Alkane (C. CNH2n.+2) und zyklische Alkane (C. CNH2n).
Was sind Alkene??
Alkene sind die Kohlenwasserstoffe, die eine Kohlenstoff-Kohlenstoff-Doppelbindung (C = C) enthalten. "Olefins" ist der alte Name, der verwendet wird, um die Familie Alkene zu beziehen. Das kleinste Mitglied dieser Familie ist Ethane (c2H4); Es wurde genannt OlefianerT Gas (in Latein: 'Oleum ' bedeutet "Öl" + "Facere" bedeutet in den frühen Tagen "zu machen". Dies liegt daran, dass die Reaktion zwischen c2H4 und Chlor gibt c2H2Cl2, Öl.
Was ist der Unterschied zwischen Alkanen und Alkenen?
Chemische Struktur von Alkanen und Alkenen
Alkane: Alkane haben die allgemeine molekulare Formel CNH2n+2. Methan (Ch4) ist das kleinste Alkan.
| Name | Chemische Formel | Akyklische Struktur |
| Methan | CH4 | CH4 |
| Ethan | C2H6 | CH3CH3 |
| Propan | C3H8 | CH3CH2CH3 |
| Butan | C4H10 | CH3CH2CH2CH3 |
| Pentan | C5H12 | CH3CH2CH2CH2CH3 |
| Hexan | C6H14 | CH3CH2CH2 CH2CH2CH3 |
| Heptane | C7H16 | CH3CH2CH2CH2CH2CH2CH3 |
| Oktan | C8H18 | CH3 CH3CH2CH2CH2CH2CH3CH3 |
Alkene: Alkene haben die allgemeine chemische Formel von CNH2n. Alkene gelten als ungesättigte Kohlenwasserstoffe, da sie nicht die maximale Anzahl von Wasserstoffatomen enthalten, die einem Kohlenwasserstoffmolekül besitzen können.
| Name | Chemische Formel | Struktur |
| Ethen | C2H4 | CH2 = CH2 |
| Propene | C3H6 | CH3Ch = ch2 |
| Butene | C4H8 | CH2 =CHCH2CH3, CH3CH = CHCH3 |
| Pentene | C5H10 | CH2 =CHCH2CH2CH3, CH3CH = CHCH2CH3 |
| Hexene | C6H12 | CH2 =CHCH2 CH2CH2CH3CH3CH = CHCH2CH2CH3 CH3CH2CH=CHCH2CH3 |
| Heptin | C7H14 | CH=CHCH2CH2CH2CH2CH3CH3Ch = ch2CH2CH2CH2CH3 |
Chemische Eigenschaften von Alkanen und Alkenen
Alkane:
Reaktivität:
Alkane sind inertiert zu vielen chemischen Reagenzien. Dies liegt daran. Daher ist es sehr schwierig, ihre Bindungen zu brechen, es sei denn, sie sind auf ziemlich hohe Temperaturen erhitzt.
Verbrennung:
Alkane können leicht in der Luft verbrennen. Die Reaktion zwischen Alkanen mit überschüssigem Sauerstoff wird als „Verbrennung“ bezeichnet. In dieser Reaktion konvertieren Alkane in Kohlendioxid (CO2) und Wasser.
CNH2n + (n + n/2) o2 → n co2 + NH2Ö
C4H10 + 13/2 o2 → 4 co2 + 5H2Ö
Butan -Sauerstoffkohlendioxidwasser
Die Verbrennungsreaktionen sind exotherme Reaktionen (sie geben Wärme ab). Infolgedessen werden Alkane als Energiequelle verwendet.
Alkene:
Reaktivität:
Alkene reagieren mit Wasserstoff in Gegenwart eines fein geteilten Metallkatalysators, um das entsprechende Alkan zu bilden. Die Reaktionsgeschwindigkeit ist ohne Katalysator sehr niedrig.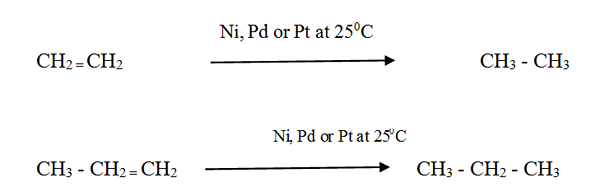
Katalytische Hydrierung wird in der Lebensmittelindustrie verwendet, um flüssige pflanzliche Öle in ein halbfarbiges Fett umzuwandeln, um Margarine und festes Kochfett zu machen.
Physikalische Eigenschaften von Alkanen und Alkenen
Formen
Alkane: Alkane existieren als Gase, Flüssigkeiten und Feststoffe. Methan, Ethan, Propan und Butan sind Gase bei Raumtemperatur. Die unverzweigten Strukturen von Hexan, Pentan und Heptan sind Flüssigkeiten. Alkane mit höherem Molekulargewicht sind Feststoffe.
CH4 zu c4H10 sind Gase
C5H12 zu c17H36 sind Flüssigkeiten und
Alkane mit höherem Molekulargewicht sind weiche Feststoff
Alkene: Alkene zeigen ähnliche physikalische Eigenschaften des entsprechenden Alkans. Alkene mit niedrigeren Molekulargewichten (C2H4 toc4H8) sind Gase bei Raumtemperatur und atmosphärischem Druck. Alkene mit höherem Molekulargewicht sind Festkörper.
Löslichkeit:
Alkane: Alkane lösen sich nicht in Wasser auf. Sie werden in nicht-polaren oder schwach polaren organischen Lösungsmitteln gelöst.
Alkene: Alkene sind aufgrund der C = C -Bindung relativ polare Moleküle; Daher sind sie in nichtpolaren Lösungsmitteln oder Lösungsmitteln mit geringer Polarität löslich. Wasser ist ein polares Molekül und Alkene sind in Wasser leicht löslich.
Dichte:
Alkane: Die Dichten der Alkane sind niedriger als die Dichte des Wassers. Ihr Dichtewert beträgt fast 0.7 g ml-1, In Anbetracht der Wasserdichte als 1.0 g ml-1.
Alkene: Die Dichten von Alkenen sind niedriger als die Dichte des Wassers.
Siedepunkte:
Alkane: Der Siedepunkt der unverzweigten Alkane nimmt mit zunehmender Anzahl von Kohlenstoffatomen und dem Molekulargewicht reibungslos zu. Im Allgemeinen haben verzweigte Alkane im Vergleich zu den unverzweigten Alkanen niedrigere Siedepunkte, die die gleiche Anzahl von Kohlenstoffatomen haben.
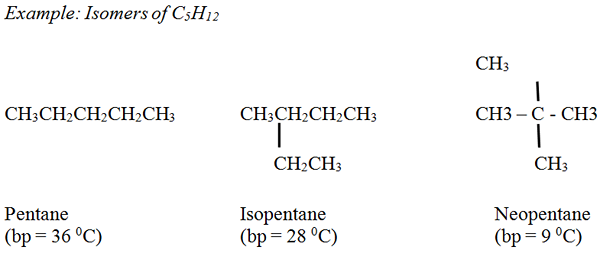
Alkene: Siedepunkte ähneln den entsprechenden Alkanen mit einer kleinen Variation.
Verweise: Cliffsnotes. (N.D.). Abgerufen am 6. Juli 2016 von hier aus. Zum-Verzeichnis-Modus. (N.D.). Abgerufen am 6. Juli 2016 von hier aus Polarität. (N.D.). Abgerufen am 6. Juli 2016 von hier aus Dipolmomente. (2013). Abgerufen am 6. Juli 2016 von hier aus Strukturelles Isomer. (N.D.). Abgerufen am 6. Juli 2016 von hier aus Eine Einführung in Alkene. (N.D.). Abgerufen am 6. Juli 2016 von hier aus Bild mit freundlicher Genehmigung: "Alken -Namen" von Chris Evans - (CC0) über Commons Wikimedia "Gesättigte C4-Kohlenwasserstoffe Ball-and-Stick" von fvasconcellos-eigene Arbeit (Public Domain) über Commons Wikimedia

