Unterschied zwischen Ammoniumnitrat und Harnstoff

Ammoniumnitrat gegen Harnstoff
Verbindungen, die Stickstoff enthalten. Ammoniumnitrat und Harnstoff sind ein solcher Stickstoff, der Feststoffe enthält.
Ammoniumnitrat
Ammoniumnitrat hat die chemische Formel von NH4NEIN3. Dies ist das Nitrat von Ammoniak und hat die folgende Struktur.
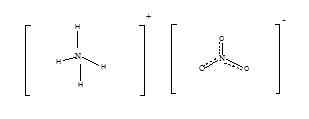
Bei Raumtemperatur und Standarddruck -Ammoniumnitrat existieren als geruchlos weißer kristalline Feststoff. Dies ist ein saures Salz mit einem pH -Wert von etwa 5.4. Seine Molmasse beträgt 80.052 g/mol. Der Schmelzpunkt von Ammoniumnitrat beträgt ungefähr 170 ° C und zersetzt ÖC. Ammoniumnitrat wird hauptsächlich für landwirtschaftliche Zwecke verwendet. Es ist reich an Stickstoff, daher wird es als Dünger verwendet, um Pflanzen Stickstoff zu versorgen. Da sein direkter Kontakt mit Chemikalie nicht gefährlich ist und die Toxizität von IT geringer ist, ist es vorteilhaft, als Dünger zu verwenden. Darüber hinaus explodiert Heizung oder Zündung Ammoniumnitrat. Daher wird es als Oxidationsmittel bei Sprengstoff verwendet. Aufgrund dieser explosiven Natur sollten wir beim Speichern von Ammoniumnitrat besonders vorsichtig sein. Ammoniumnitrat ist stabil, aber wenn es sich im geschmolzenen Zustandsrisiko für Explosion befindet, ist höher. Das Risiko nimmt zu, wenn es um Kontakt mit oxidierbaren Materialien wie Öl, Diesel, Papier, Lappen oder Stroh geht. Die Produktion von Ammoniumnitrat ist eine einfache chemische Reaktion. Wenn Salpetersäure mit Ammoniakflüssigkeit reagiert wird, wird Ammoniumnitrat in der Lösungsform erzeugt. Industriell werden konzentrierte Salpetersäure und Ammoniakgas zur Produktion verwendet. Da dies eine sehr exotherme und gewalttätige Reaktion ist, ist es schwierig, sie in großem Maßstab zu produzieren. Als Salz ist Ammoniumnitrat in Wasser sehr löslich. Daher kann es abgewaschen werden, wenn es als Dünger verwendet wird. Dies könnte eine tödliche Erkrankung für das Wasserleben sein.
Harnstoff
Harnstoff hat die molekulare Formel von CO (NH2)2 und die folgende Struktur.
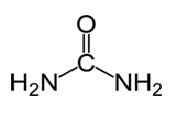
Es ist ein Carbamid mit der funktionellen Gruppe c = o. Zwei NH2 Gruppen sind von zwei Seiten an den Carbonylkohlenstoff gebunden. Harnstoff wird natürlich bei Säugetieren im Stickstoffstoffwechsel produziert. Dies ist als Harnstoffzyklus bekannt, und die Oxidation von Ammoniak oder Aminosäuren produziert Harnstoff in unserem Körper. Der größte Teil des Harnstoffs wird durch Nieren mit Urin ausgeschieden, während einige mit Schweiß ausgeschieden werden. Die hohe Wasserlöslichkeit des Harnstoffs ist hilfreich, wenn es aus dem Körper ausscheidet. Harnstoff ist ein farbloser, geruchloser Feststoff und ungiftig. Abgesehen von einem Stoffwechselprodukt besteht die Hauptverwendung darin, Dünger zu produzieren. Harnstoff ist einer der häufigsten Stickstofffreisetzungsdünger und hat einen hohen Stickstoffgehalt im Vergleich zu anderen festen Stickstoffdüngern. Im Boden wird Harnstoff in Ammoniak und Kohlendioxid umgewandelt. Dieses Ammoniak kann durch Bodenbakterien in Nitrit umgewandelt werden. Darüber hinaus wird Harnstoff verwendet, um Sprengstoffe wie Harnstoffnitrat zu produzieren. Es wird auch als Rohstoff verwendet, um Chemikalien wie Kunststoffe und Klebstoffe zu produzieren.
| Was ist der Unterschied zwischen Ammoniumnitrat und Harnstoff? • Die molekulare Formel von Ammoniumnitrat ist NH4NEIN3. Die molekulare Formel von Harnstoff ist CO (NH2)2. • Ammoniumnitrat ist ein Salz, während Harnstoff nicht ist. Es ist ein Carbamid (organisches Molekül). • Wenn in Wasser Ammoniumnitrat gelöst wird, erzeugt er eine saure Lösung. Im Gegensatz dazu sind Harnstofflösungen weder sauer noch alkalisch. |


