Unterschied zwischen Amphiprotikal und Polyprotisch
Der Schlüsselunterschied zwischen amphiprotrot und polyprot ist das Amphiprotic bezieht sich auf die Fähigkeit, Protonen sowohl zu spenden als.
Die Begriffe amphiprototisch und polyprot werden als Adjektive zur Beschreibung chemischer Verbindungen verwendet. Diese Begriffe beschreiben die Fähigkeit oder Unfähigkeit, Protonen zu spenden/zu akzeptieren. In diesen Begriffen bedeutet „proprot“ Protonen, die die H sind+ Ionen, die aus einer chemischen Verbindung entfernt werden können.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist amphipotisch
3. Was ist polyprot
4. Seite an Seitenvergleich - Amphiprotische gegen polyprotische tabellarische Form
5. Zusammenfassung
Was ist amphipotisch?
Amphiprotische bezieht sich auf die Fähigkeit einer chemischen Verbindung, Protonen zu spenden oder zu akzeptieren. Insbesondere können amphipotische chemische Verbindungen sowohl Protonen an oder von anderen Verbindungen spenden als auch annehmen. In diesem Zusammenhang beziehen wir uns auf H+ Ionen als Protonen. Amphipotische Verbindungen können entweder eine Säure oder eine Base sein. Daher haben diese Verbindungen sowohl saure als auch grundlegende Eigenschaften.

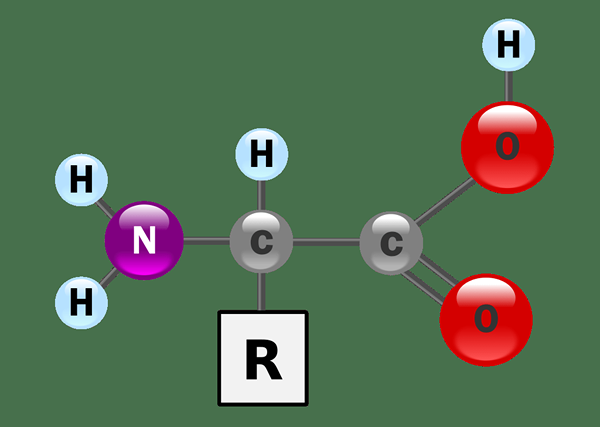
Abbildung 01: Aminosäuren sind amphipotisch
Beispiele für amphiprototische chemische Verbindungen umfassen Aminosäuren, die Amingruppen und Carboxylgruppen enthält, Proteine, die aus Aminosäuren bestehen.
Was ist polyprot?
Polyprot bezieht sich auf die Fähigkeit einer chemischen Verbindung, mehr als ein Proton zu spenden. Hier bedeutet „Poly“ viele und „-Protrot“ bedeutet Protonspende. Es gibt zwei Arten von polyproprotem chemischen Spezies als polyprotische Säuren und polyprotische Basen.
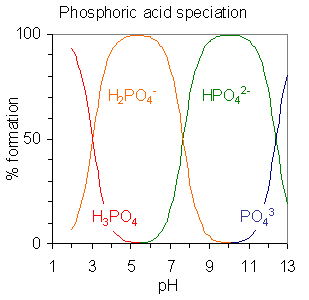
Abbildung 02: Phosphorsäure ist eine polyprotische Säure. Es hat drei abnehmbare Protonen.
Polyprotische Säuren können mehr als ein Proton pro Molekül freigeben. Polyprotische Basen sind chemische Spezies, die mehr als ein Proton pro Molekül akzeptieren können. Zum Beispiel Schwefelsäure, Phosphorsäure, Kohlensäuresäure, Schwefelsäure usw. sind polyprotische Säuren. Phosphation, Sulfation, Carbonation usw. sind Beispiele für polyprotische Basen.
Was ist der Unterschied zwischen amphiprotisch und polyprotisch?
Die Begriffe amphiprototisch und polyprotisch beziehen sich auf die Entfernung von Protonen aus chemischen Verbindungen. Der wichtigste Unterschied zwischen amphiprototisch und polyprotisch besteht darin, dass sich amphiprotic auf die Fähigkeit bezieht, Protonen zu spenden und zu akzeptieren.
Darüber. Einige Beispiele für amphipotische chemische Verbindungen umfassen Aminosäuren, Proteine und Wasser, während Beispiele für polyproprotische chemische Spezies Phosphorsäure, Schwefelsäure, Schwefelsäure und Phosphation umfassen.
Die folgende Tabelle fasst den Unterschied zwischen amphipotischen und polyprorotischen chemischen Spezies zusammen.

Zusammenfassung -Amphiprotische gegen polyprotische
Die Begriffe amphiprototisch und polyprotisch beziehen sich auf die Entfernung von Protonen aus chemischen Verbindungen. Der wichtigste Unterschied zwischen amphiprototisch und polyprotisch besteht darin, dass sich amphiprotic auf die Fähigkeit bezieht, Protonen sowohl zu spenden als. Einige Beispiele für amphipotische chemische Verbindungen umfassen Aminosäuren, Proteine und Wasser, während einige Beispiele für polyproprotische chemische Spezies Phosphorsäure, Schwefelsäure, Schwefelsäure und Phosphation umfassen.
Referenz:
1. Helmenstine, Anne Marie. „Amphiprotische Definition in der Chemie.”Thoughtco, Februar. 11, 2020, hier erhältlich.
2. „11.11: Amphipotische Arten.”Chemie libretexten, libretexten, 7. Februar. 2020, hier erhältlich.
3. „Polyprotische Säuren und Basen.”Chemistry Libretexten, Libretexte, 5. Juni 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Aminosäureball" von Gyassinemrabettalk ✉Dis W3C-nicht genannte Vektorbild wurde mit Inkscape erstellt. - Eigene Arbeit (Public Domain) über Commons Wikimedia
2. "Phosphor3" von Petergans (Diskussion) - Ein Artenverteilungsdiagramm, wie in Abschnitt 2 beschrieben.4, Public Domain) über Commons Wikimedia


