Unterschied zwischen Anilin und Benzylamin
Der Schlüsselunterschied Zwischen Anilin und Benzylamin ist das Die Amingruppe von Anilin ist direkt am Benzolring befestigt, während die Amingruppe von Benzylamin indirekt durch einen -ch am Benzolring befestigt ist2- Gruppe.
Anilin und Benzylamin sind aromatische organische Verbindungen. Beide Verbindungen enthalten Benzolringe und Amingruppen, aber die Amingruppe hängt das Benzol auf unterschiedliche Weise an. entweder direkt oder indirekt. Daher haben die beiden Verbindungen unterschiedliche chemische und physikalische Eigenschaften.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Aniline
3. Was ist Benzylamin
4. Nebenseitiger Vergleich - Anilin gegen Benzylamin in tabellarischer Form
5. Zusammenfassung
Was ist Aniline?
Anilin ist eine aromatische organische Verbindung mit der chemischen Formel C6H5NH2. Es hat eine Phenylgruppe (einen Benzolring) mit einer angeschlossenen Amingruppe (-nh2). Es ist das einfachste aromatische Amin. Darüber hinaus ist diese Verbindung leicht pyramidalisiert und flacher als ein aliphatischer Amin. Seine Molmasse ist 93.13 g/mol. Der Schmelzpunkt beträgt –6.3 ° C, während der Siedepunkt 184 ist.13 ° C. Es hat den Geruch von faulen Fischen.
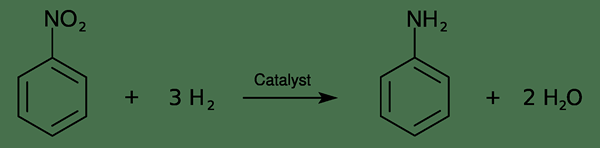
Industriell können wir diese Verbindung über zwei Schritte produzieren. Der erste Schritt ist die Nitrierung von Benzol mit einem konzentrierten Gemisch aus Salpetersäure und Schwefelsäure (bei 50 bis 60 ° C). Es gibt Nitrobenzol. Dann können wir Nitrobenzol in Gegenwart eines Metallkatalysators in Anilin hydrieren. Die Reaktion ist wie folgt;

Darüber hinaus wird diese Verbindung hauptsächlich bei der Herstellung von Polyurethan -Vorläufern verwendet. Abgesehen davon können wir diese Verbindung bei der Herstellung von Farbstoffen, Medikamenten, Sprengmaterialien, Kunststoffen, fotografischen und gummiartigen Chemikalien usw. verwenden.
Was ist Benzylamin?
Benzylamin ist eine aromatische organische Verbindung mit der chemischen Formel C6H5CH2NH2. Es hat eine Amingruppe, die über eine -ch2 -Gruppe an eine Phenylgruppe gebunden ist. Außerdem tritt diese Verbindung als farblose Flüssigkeit auf und hat einen ammoniakähnlichen Geruch. Die Molmasse von Benzylamin beträgt 107.15 g/mol. Der Schmelzpunkt ist 10 ° C, während der Siedepunkt 185 ° C beträgt.
Wir können diese Verbindung über die Reaktion von Benzylchlorid mit Ammoniak produzieren. Außerdem können wir es durch Benzonitrilreduzierung produzieren. Die Reaktion ist wie folgt;
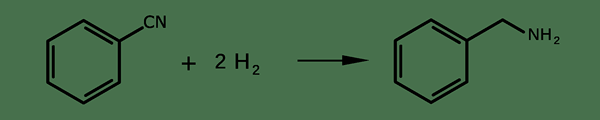
Darüber hinaus ist diese Verbindung ein häufiger Vorläufer für die organische Synthese und die Produktion vieler Pharmazeutika.
Was ist der Unterschied zwischen Anilin und Benzylamin?
Anilin ist eine aromatische organische Verbindung mit der chemischen Formel C6H5NH2 Während Benzylamin eine aromatische organische Verbindung ist, die die chemische Formel C hat6H5CH2NH2. Der wichtigste Unterschied zwischen Anilin und Benzylamin besteht darin, dass in Anilin die Amingruppe direkt mit dem Benzolring befestigt wird, während die Amingruppe in Benzylamin den Benzolring indirekt durch eine -Ch2 -Gruppe befestigt.
Darüber hinaus können wir Anilin durch Nitrierung von Benzol, gefolgt von Hydrierungsnitrobenzol in Anilin produzieren, während wir Benzylamin durch die Reaktion von Benzylchlorid mit Ammoniak produzieren können. Außerdem ist ein weiterer Unterschied zwischen Anilin und Benzylamin ihr Geruch. Anilin hat den Geruch von faulen Fischen, während der Geruch von Benzylamin dem Geruch von Ammoniak ähnlich ist.

Zusammenfassung -Aniline gegen Benzylamin
Anilin ist eine aromatische organische Verbindung mit der chemischen Formel C6H5NH2 Während Benzylamin eine aromatische organische Verbindung ist, die die chemische Formel C hat6H5CH2NH2. Zusammenfassend lässt sich sagen, dass der Hauptunterschied zwischen Anilin und Benzylamin darin besteht2- Gruppe.
Referenz:
1. "Anilin.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 26. September. 2013, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Aniline aus Nitrobenzol" von Hermann Luyken - eigene Arbeit (CC0) über Commons Wikimedia
2. "Benzonitrile Hydrierung" von Hermann Luyken - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


