Unterschied zwischen wässriger und nichtwässriger Titration
Der Schlüsselunterschied zwischen wässriger und nichtwässriger Titration ist, dass wässrige Titrationen Wasser als Lösungsmittel zum Auflösen der Analytproben für die Titration verwenden, während nichtwässrige Titrationen organische Lösungsmittel zum Auflösen der Probe verwenden.
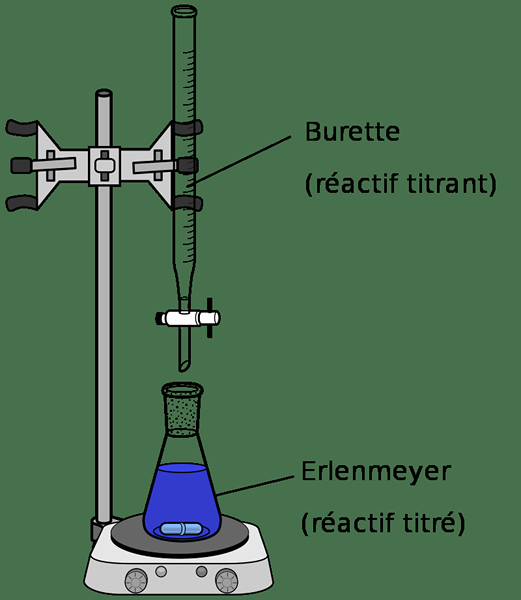
Titration ist eine analytische Technik, die für die Messung der Konzentration einer bestimmten chemischen Lösung nützlich ist. Wir können dies mit einer Lösung mit einer bekannten Konzentration tun. Ein Titrationsprozess erfordert einen bestimmten Apparat.
In einem Titrationsapparat gibt es eine Burette, die normalerweise eine Standardlösung mit einer bekannten Konzentration enthält. Wenn die Lösung in der Bürette keine Standardlösung ist, sollte sie mit einem primären Standard standardisiert werden. Der Titrationskolben ist mit einer Probe gefüllt, die eine chemische Komponente mit einer unbekannten Konzentration enthält. Wenn die standardisierte Lösung (in Burette) nicht als Selbstbekenntnis fungieren kann, sollten wir der Probe im Titrationskolben einen geeigneten Indikator hinzufügen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist eine wässrige Titration
3. Was ist eine nichtwässrige Titration
4. Wässrige gegen nichtwässrige Titration in tabellarischer Form
5. Zusammenfassung - wässrige gegen nichtwässrige Titration
Was ist eine wässrige Titration?
Wässrige Titrationen sind analytische Techniken, bei denen wir die Menge der in der Probe vorhandenen gewünschten Substanz unter Verwendung von Wasser als Lösungsmittel der Probe bestimmen können. Es gibt verschiedene Arten von wässrigen Titrationen, die wir in der analytischen Chemie verwenden können, einschließlich Säure-Base-Titrationen, Redox-Titrationen, komplexometrischen Titrationen und Niederschlagstitrationen.

Abbildung 01: Diagramm einer Säure-Base-Titration
Arten von Titrationen
Säurebasis -Titrationen sind auch benannt Neutralisationstitrationen, und wir können die unbekannte Probe in Wasser auflösen, um die Menge an Säure/Base in der Probe unter Verwendung von Base/Säure in der Bürette zu bestimmen. Normalerweise ist die resultierende Lösung nach Abschluss der Titration eine neutrale Lösung mit pH = 7.0. Darüber hinaus wird oft ein Salz gebildet.
Redox -Titrationen sind Oxidationsreduktionsreaktionen, bei denen ein Reduktionsmittel mit einem Oxidationsmittel reagiert, das es uns ermöglicht, die Menge der gewünschten Substanz in einer Probe zu bestimmen. Die Probe befindet sich im wässrigen Zustand, weil wir sie in Wasser auflösen müssen.
In Komplexometrische Titrationen, Ein komplexes Molekül bildet sich am Endpunkt der Titration. Diese chemische Reaktion findet in einer wässrigen Lösung statt, die uns dazu veranlasst, diesen Reaktionstyp unter wässrigen Titrationen zu kategorisieren.
Niederschlagstitration ist eine Art von Titration, bei der die Bildung eines festen Niederschlags am Boden des Kolbens auftritt, den wir für die Titration verwenden. In dieser Reaktionstyp befindet sich der Analyte in einer wässrigen Lösung, aber der Niederschlag, der sich nach Abschluss der Titration bildet, muss in Wasser unlöslich sein.
Was ist eine nichtwässrige Titration?
Nichtwässrige Titrationen sind analytische Techniken, bei denen wir die Menge der in der Probe vorhandenen in der Probe unter Verwendung von organischen Flüssigkeiten als Lösungsmittel für die Probe bestimmen können. Daher ist diese Art von Titrationen wichtig, um die Menge eines bestimmten Analyten in einer Probe zu bestimmen, die in Wasser unlöslich ist. Es gibt verschiedene Arten von nichtwässrigen Titrationen, einschließlich Säure-Base-Titrationen, Redoxtitrationen, Iodometrie und Iodimetrie.
In nichtwässrigen Titrationen der Säure-Basen findet die chemische Reaktion in organischen Lösungsmitteln wie Gletscher Essigsäure statt. In Redoxreaktionen der nichtwässrigen Titrationskategorie erfolgt die chemische Reaktion durch die Verwendung von wasserunlöslichen Oxidations- und Reduktionsmitteln.
Darüber hinaus beinhalten nichtwässrige Titrationen wie Iodometrie und Iodimetrie nichtwässrige Lösungen von Analytproben. Iodometrie beinhaltet die Freisetzung von Jod aus dem Reaktionsgemisch, und Iodimetrie beinhaltet die Verwendung einer Probe mit einer bekannten Jodkonzentration.
Was ist der Unterschied zwischen wässriger und nichtwässriger Titration?
Wässrige und nichtwässrige Titrationen sind analytische Techniken. Der Hauptunterschied zwischen wässriger und nichtwässriger Titration besteht darin, dass wässrige Titrationen Wasser als Lösungsmittel zum Auflösen der Analytproben für die Titration verwenden, während nichtwässrige Titrationen organische Lösungsmittel zum Auflösen der Probe verwenden.
Die folgende Infografik zeigt die Unterschiede zwischen wässriger und nichtwässriger Titration in tabellarischer Form.
Zusammenfassung -wässrige gegen nichtwässrige Titration
Titrationen sind analytische Techniken, mit denen wir die Menge der gewünschten Substanz in einer bestimmten Probe quantifizieren können. Der Hauptunterschied zwischen wässriger und nichtwässriger Titration besteht darin, dass wässrige Titrationen Wasser als Lösungsmittel zum Auflösen der Analytproben für die Titration verwenden, während nichtwässrige Titrationen organische Lösungsmittel zum Auflösen der Probe verwenden.
Referenz:
1. „Nicht wässrige Titration - Definition, Theorie und Arten von nicht wässrigen Lösungsmitteln.Byjus. 5. August. 2020.
Bild mit freundlicher Genehmigung:
1. "Acid-Base-Titration-Fr" von MEINGER-Syrabas-Titrering.SVG (CC BY-SA 4.0) über Commons Wikimedia


