Unterschied zwischen Argon und Sauerstoff
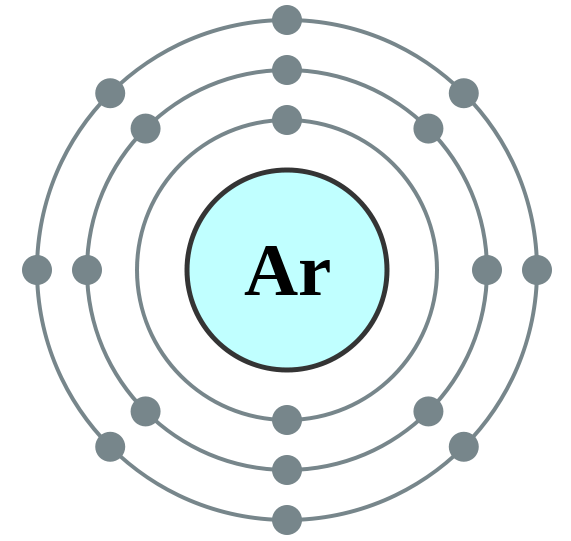
Schlüsselunterschied - Argon vs. Sauerstoff
Argon und Sauerstoff sind zwei chemische Elemente in der Periodenzüchtertabelle. Sie sind beide gasförmige Elemente, in denen Argon in der edlen Gasfamilie und Sauerstoff aus der Chalkogengruppe in der Periodenzüchttabelle ist. Argon ist ein ineres Gas, während Sauerstoff ein sehr reaktives Gas ist. Sauerstoff ist eines der am häufigsten vorkommenden Elemente auf diesem Planeten, während Argon eine der am häufigsten vorkommenden Edelgase ist. Argon wird produziert, wenn Hochreinheitssauerstoff hergestellt wird. Sie haben relativ enge Siedepunkte, aber ihre chemischen Eigenschaften unterscheiden sich stark voneinander. Wie Sie die Unterschiede zwischen Argon und Sauerstoff beobachten können, sind zahlreich. Dieser Artikel versucht, Ihnen ein klares Verständnis der Unterschiede zu vermitteln.
Was ist Argon?
Argon (AR) ist ein Mitglied einer besonderen Familie; Sie werden als "selten", "edel" oder "inerte" Gase bezeichnet. Alle Gase in dieser Familie haben eine völlig gefüllte äußerste Schale und ihre chemische Reaktivität ist fast Null. Argon ist ein monatomisches, farblos, geruchlos, geschmacklos und ungiftiges Gas. Argon ist im Wasser leicht löslich. Seine Fülle in der Atmosphäre beträgt fast 0.934% nach Volumen. Argon gilt als das am häufigsten vorkommende Inertgas. Alle Mitglieder der Noble Gas Family emittieren Licht, wenn sie elektrisch aufgeregt sind; In diesem Fall produziert Argon ein hellblau-violettes Licht.
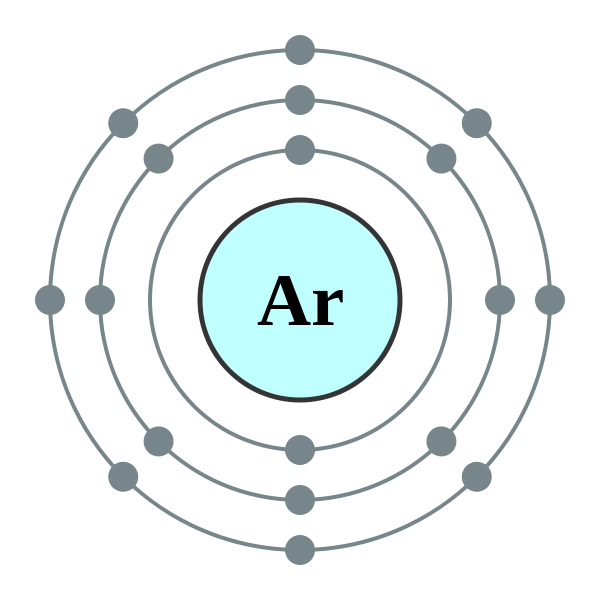
Was ist Sauerstoff?
Sauerstoff kann als als eines der am häufigsten vorkommenden Elemente der Erde. Etwa 21% des freien elementaren Sauerstoffs sind in unserer Atmosphäre vorhanden. Zusätzlich wird es mit anderen Verbindungen wie Wasser und Mineralien kombiniert. Sogar unsere menschlichen Körperfunktionen verwenden Sauerstoff und enthält 65% Sauerstoff durch Masse. Sauerstoff tritt natürlich als Diatom -Gasmoleküle auf, o auf2 (G). Es ist ein farbloses, geschmackloses und geruchloses Gas mit seinen einzigartigen chemischen und physikalischen Eigenschaften. Die Sauerstoffdichte ist größer als Luft und hat eine sehr geringe Löslichkeit im Wasser.
Die chemische Reaktivität von Sauerstoff ist sehr hoch; Es reagiert mit fast allen Elementen unter verschiedenen Bedingungen, mit Ausnahme von edlen Gasen und einigen weniger reaktiven Metallen. Sauerstoff ist das reaktivste Element neben Fluor (F).
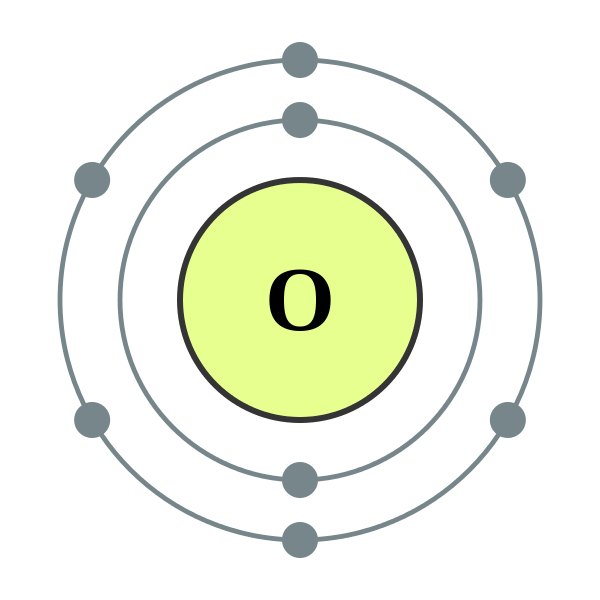
Was ist der Unterschied zwischen Argon und Sauerstoff?
Eigenschaften:
| Eigentum | Argon | Sauerstoff |
| Ordnungszahl | 18 | 8 |
| Elektronische Konfiguration | 1s² 2S² 2p63s² 3p⁶ | 1s² 2S² 2p⁴ |
| Siedepunkt | -185.9 ° C (-302).6 ° F) | -182 ° C (-297 ° F) |
| Schmelzpunkt | -189 ° C (-308 ° F) | -218 ° C (-361 ° F) |
Schwere:
Argon: Argon ist 1.4 mal so schwer wie Luft; Es ist nicht atmungsaktiv wie Sauerstoff und kann durch Einstellen in den unteren Teilen der Lunge zugreifen lassen.
Sauerstoff: Sauerstoff auch dichter als Luft, aber es ist ein leichtes Gas, das atmungsaktiv ist.
Verwendet:
Argon: Argon ist selbst bei hohen Temperaturen ein inertes Gas und wird aus diesem Grund in einigen kritischen industriellen Prozessen wie der Herstellung von hochwertigem Edelstahl und bei der Herstellung von Verunreinigungs -freien Siliziumkristallen für Halbleiter verwendet. Es wird häufig als inerter Füllstoffgas in Glühbirnen verwendet. Es bleibt nicht reaktiv, selbst wenn die Glühbirne auf hohe Temperaturen erhitzt wird.
Sauerstoff: Sauerstoff wird in der Metallindustrie mit Acetylen und anderen Brennstoffe zum Schneiden, Schweißen, Schmelzen, Härten, Schaleln und Reinigen häufig eingesetzt. Gaser Sauerstoff- oder Sauerstoffangerufener Luft wird in der Stahl- und Eisenherstellung verwendet.
Die Erdölindustrie verwendet auch intensiv Sauerstoff als Futter, um mit dem Kohlenwasserstoff zu reagieren, um Chemikalien wie Aldehyde und Alkohole zu produzieren.
Bild mit freundlicher Genehmigung:
1. Elektronenschale 018 Argon - Kein Etikett von Commons: Benutzer: Pumbaa (Originalarbeit von Commons: Benutzer: Greg Robson) [CC BY -SA 2.0] über Wikimedia Commons
2. Elektronenschal.0] über Wikimedia Commons


