Unterschied zwischen Atomgewicht und Atommasse
Der Schlüsselunterschied Zwischen Atomgewicht und Atommasse ist das Atomgewicht ist das durchschnittliche Gewicht eines Elements in Bezug auf alle Isotope und ihre relativen Häufigkeiten, aber Atommasse ist die Masse eines einzelnen Atoms.
Die meisten Menschen verwenden die Begriffe Atommasse und Atomgewicht austauschbar. Sie tragen jedoch unterschiedliche Bedeutungen, und es verursacht einen signifikanten Fehler bei den Berechnungen der Schüttgüter, wenn wir diese beiden Begriffe als einen annehmen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Atomgewicht
3. Was ist Atommasse
4. Seite an Seitenvergleich - Atomgewicht gegen Atommasse in tabellarischer Form
5. Zusammenfassung
Was ist Atomgewicht?
Atomgewicht ist das durchschnittliche Gewicht eines Elements in Bezug auf alle Isotope und ihre relativen Häufigkeiten. In den meisten Fällen haben chemische Elemente Isotope; Isotope sind die verschiedenen Formen des gleichen chemischen Elements. Isotope haben die gleiche Anzahl von Protonen (wodurch sie demselben chemischen Element gehören) und unterschiedliche Anzahl von Neutronen im Atomkern. Es gibt verschiedene Prozentsätze verschiedener Isotope, die in der Natur auftreten. Wir müssen die Atommassen aller Isotope und ihre Prozentsätze berücksichtigen, wenn wir das Atomgewicht eines chemischen Elements erhalten. Dort können wir die durchschnittliche Masse unter Verwendung der Atommassen jedes Isotops berechnen, um das Atomgewicht zu erhalten. Das Atomgewicht, das wir in der Periodenzüchttabelle sehen, werden gemäß diesem Phänomen berechnet.
Wir können die folgenden zwei Schritte für diese Berechnung verwenden
- Konvertieren Sie zunächst die Prozentsätze in Dezimalwerte, indem Sie sie mit 100 teilen.
- Multiplizieren Sie als nächstes die Atommassen jedes Isotops von diesen Dezimalwerten entsprechend.
- Fügen Sie endlich die Antworten zusammen hinzu, um die endgültige Antwort zu erhalten.
Video 1: Berechnung des Atomgewichts
Beispiel: Angenommen, wir haben 98% C-12-Isotop und 2% des C-13-Isotops in der Natur. Berechnen wir das Atomgewicht von Kohlenstoff unter Verwendung der Atommassen dieser Isotope.
- Konvertieren in Dezimalwerte:
- Der Dezimalwert für den Prozentsatz von C-12 beträgt 0.98 (erhalten durch Teilen von 98 von 100).
- Der Dezimalwert für den Prozentsatz von C-13 beträgt 0.02 (erhalten durch Teilen von 2 von 100).
- Multiplikation von Atommassen jedes Isotops aus den Dezimalwerten:
- 12 x 0.98 = 11.76
- 13 x 0.02 = 0.26
- Zugabe von Antworten zusammen, um die endgültige Antwort zu erhalten:
- 76 + 0.26 = 12.02
Schließlich können wir das Atomgewicht des Kohlenstoffs des chemischen Elements als 12 bekommen.02 AMU (Atommasseneinheiten). Darüber hinaus können wir diesen Begriff als „relative Atommasse“ nennen, da er ein Durchschnitt der tatsächlichen Atommassen von Isotopen ist.
Was ist Atommasse?
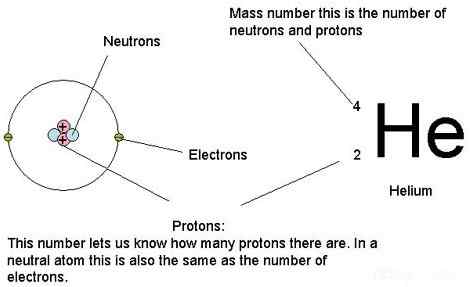
Atome enthalten hauptsächlich Protonen, Neutronen und Elektronen. Atommasse ist einfach die Masse eines Atoms. Mit anderen Worten, es ist die Sammlung von Massen aller Neutronen, Protonen und Elektronen in einem einzelnen Atom, insbesondere wenn sich das Atom nicht bewegt (Ruhmasse). Wir nehmen nur die Ruhemasse ein, weil nach den Grundlagen der Physik, wenn sich Atome in einer sehr hohen Geschwindigkeit bewegen, die Massen erhöhen. Die Masse der Elektronen ist jedoch im Vergleich zu den Massen von Protonen und Neutronen erheblich sehr gering. Daher können wir sagen, dass der Beitrag der Elektronen zu einer Atommasse geringer ist. Daher können wir die Masse eines Elektrons bei der Berechnung der Atommasse vernachlässigen. Vor allem unterschiedliche Isotope haben unterschiedliche Atommassen, obwohl sie zu demselben chemischen Element gehören, weil sie unterschiedliche Anzahl von Neutronen haben.

Abbildung 01: Wir können die Massen von Protonen, Neutronen und Elektronen eines Atoms verwenden, um die Atommasse zu berechnen
Darüber hinaus sind die Massen von Atomen extrem klein, daher können wir sie nicht in normalen Masseneinheiten wie Gramm oder Kilogramm ausdrücken. Für unsere Zwecke verwenden wir eine andere Einheitsanruf -Atommasseneinheit (AMU), um die Atommasse zu messen. In ähnlicher Weise ist 1 Atommasseneinheit der Ein-zweites Masse eines C-12-Isotops. Wenn wir eine Masse eines Atoms aus der Masse der Masse der Masse eines C-12-Isotops teilen, können wir seine relative Masse bekommen. Im allgemeinen Gebrauch, wenn wir die relative Atommasse eines Elements sagen, meinen wir ihr Atomgewicht (weil wir sie unter Berücksichtigung aller Isotope berechnen).
Was ist der Unterschied zwischen Atomgewicht und Atommasse?
In den meisten Fällen verwenden wir die Begriffe Atomgewicht und Atommasse als gleich. Diese beiden Begriffe unterscheiden sich jedoch hauptsächlich nach der Definition voneinander. Nach der Definition besteht der Hauptunterschied zwischen Atomgewicht und Atommasse darin, dass das Atomgewicht das durchschnittliche Gewicht eines Elements in Bezug auf alle Isotope und ihre relativen Häufigkeiten ist, während die Atommasse die Masse eines einzelnen Atoms ist.
Darüber hinaus können wir einen weiteren wichtigen Unterschied zwischen Atomgewicht und Atommasse identifizieren, indem wir den Weg der Berechnung jedes Werts berücksichtigen. Wir sollten das Atomgewicht unter Verwendung der prozentualen Häufigkeit aller Isotope eines chemischen Elements in der Natur berechnen, während wir die Atommasse einfach berechnen können, indem wir einfach die Massen von Protonen, Neutronen und Elektronen eines Atoms hinzufügen.
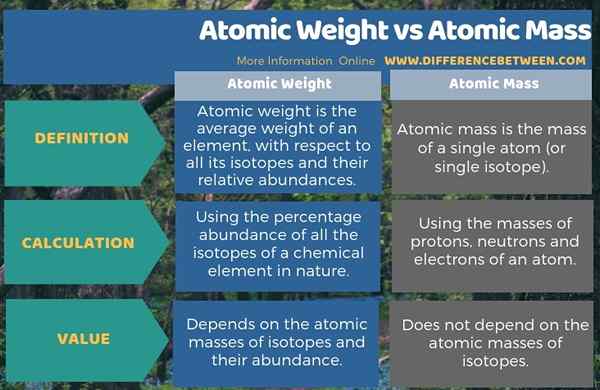
Zusammenfassung -Atomgewicht gegen Atommasse
Atomgewicht und Atommasse sind zwei wichtige Begriffe, die wir häufig in chemischen Berechnungen verwenden. Der Hauptunterschied zwischen Atomgewicht und Atommasse besteht darin, dass das Atomgewicht das durchschnittliche Gewicht eines Elements in Bezug auf alle Isotope und ihre relativ.
Referenz:
1. Wichers, Edward und H. Steffen Peiser. "Atomares Gewicht.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 15. Dezember. 2017. Hier verfügbar
2. Helmenstine, Anne Marie, ph.D. „Wie man die Atommasse berechnet.”Thoughtco, APR. 1, 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.”133317385“ von Elearn.Punjab (CC0) über Vimeo
2.”Atomnummer -Darstellung” von MaterialScientist (CC0) über Commons Wikimedia


