Unterschied zwischen Autoionisierung und Autoprotolyse
Der Schlüsselunterschied zwischen Autoionisierung und Autoprotolyse ist das Autoionisation ist die Umwandlung eines neutralen Zustands einer chemischen Spezies in einen ionisierten Zustand, während Autoprotolyse die Übertragung eines Protons zwischen zwei identischen chemischen Spezies zur Bildung ionisierter Formen ist.
Sowohl die Autoionisation als auch die Autoprotolyse beschreiben die beiden Methoden zur Bildung ionisierter Spezies, i.e. Kationen und Anionen. Dies sind spontane Reaktionen, bei denen Ionisation ohne die Wirkung eines externen Faktors auftritt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Autoionisierung
3. Was ist Autoprotolyse
4. Seite für Seitenvergleich - Autoionisation gegen Autoprotolyse in tabellarischer Form
5. Zusammenfassung
Was ist Autoionisierung?
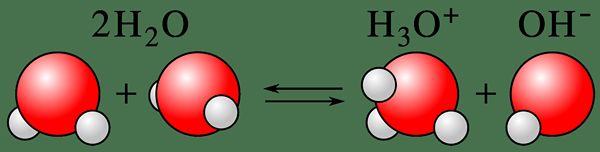
Autoionisation ist der Prozess der Umwandlung eines neutralen Zustands einer chemischen Spezies in einen ionisierten Zustand. Der Begriff beschreibt normalerweise die Ionisierung von Wassermolekülen. Daher können wir es entweder Selbstionalisierung von Wasser oder automatische Dissoziation von Wasser nennen. Hier entprotoniert ein Wassermolekül, ein Hydroxidion zu bilden, OH- und ein Wasserstoffionen, h+ (ein Proton). Hier protoniert die Deprotonierung sofort ein anderes Wassermolekül und führt zur Bildung eines Hydroniumions (H3O+). Dieser Prozess ist also ein gutes Beispiel für die amphotere Natur des Wassers.

Abbildung 01: Selbstionisierung eines Wassermoleküls
Darüber hinaus beschreibt dieser Prozess die amphotere Natur von Wasser. Amphoterische Natur bedeutet, dass Wasser sowohl als Säure als auch als Base wirken kann, da die Autoionisation sowohl Protonen als auch Hydroxidionen bildet, was dem Wasser die Fähigkeit gibt, sowohl Säuren als auch Basen in geringem Maße zu neutralisieren. Zum Beispiel Hydroniumion oder h3Ö+ Ion kann milde Basen neutralisieren, und Hydroxidionen können milde Säuren neutralisieren.
Was ist Autoprotolyse?
Autoprotolyse ist der Übertragungsverfahren eines Protons zwischen identischen chemischen Spezies zur Bildung ionisierter Spezies. Hier fungiert einer der beiden identischen Moleküle als Brønsted -Säure und setzt ein Proton frei. Das andere Molekül kann dieses Proton akzeptieren. Daher fungiert dieses andere Molekül als Brønsted -Basis. Die Selbstionisierung von Wasser ist ein Beispiel für die Autoprotolyse. Darüber hinaus unterscheidet sich dieser Begriff von der Autoprotonolyse, da die Autoprotonolyse die Spaltung einer chemischen Bindung durch Säuren beschreibt.
Einige andere Beispiele für chemische Verbindungen, die sich einer Autoprotolyse unterziehen, umfassen Ammoniak und Essigsäure;
Autoprotolyse von Ammoniak:
2nh3 ⇌ nh2- + NH4+
Autoprotolyse von Essigsäure:
2ch3Cooh ⇌ ch3GURREN- + CH3Cooh2+
Was ist der Unterschied zwischen Autoionisierung und Autoprotolyse?
Sowohl die Autoionisierung als auch die Autoprotolyse sind spontane Reaktionen. Der Schlüsselunterschied zwischen Autoionisierung und Autoprotolyse besteht darin. Ein Beispiel für die Autoionisierung ist Wasser, während Wasser, Ammoniak und Essigsäure einige Beispiele für die Autoprotolyse sind.
Darüber hinaus entprotoniert ein Wassermolekül im Prozess der Autoionisation (auch als Selbstionisierung von Wasser oder automatischer Dissoziation bezeichnet) ein Wassermolekül, um ein Hydroxidion zu bilden Autoprotolyse, einer der beiden identischen Moleküle beteiligt. Darüber hinaus beschreibt der Autoionisierungsprozess von Wasser die amphotere Natur (es kann sowohl milde Säuren als auch milde Basen neutralisieren) von Wasser. Andererseits beschreibt die Autoprotolyse die amphotere Natur chemischer Verbindungen wie Wasser, Essigsäure und Ammoniak.
Die folgende Infografik fasst den Unterschied zwischen Autoionisierung und Autoprotolyse zusammen.
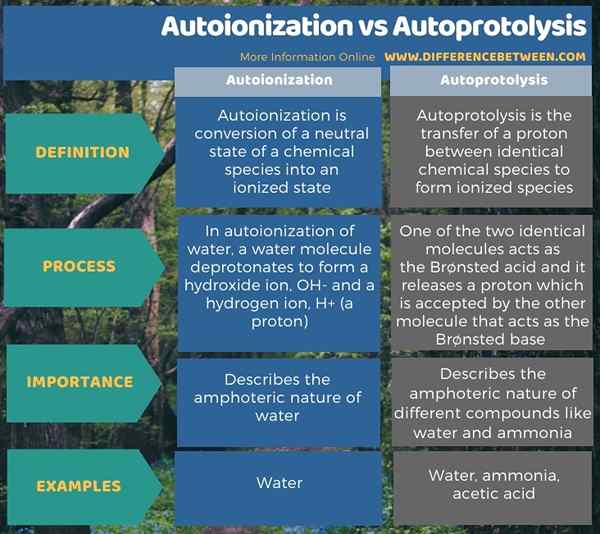
Zusammenfassung -Autoionisierung gegen Autoprotolyse
Sowohl die Autoionisierung als auch die Autoprotolyse sind spontane Reaktionen. Der Schlüsselunterschied zwischen Autoionisierung und Autoprotolyse besteht darin.
Referenz:
1. „Selbstionisierung von Wasser.”Wikipedia, Wikimedia Foundation, 3. Juni 2019, hier erhältlich.
2. „Autoprotolyse.Wikipedia, Wikimedia Foundation, 24. September. 2019, hier erhältlich.
3. „Wasserautoionisation.”Chemistry Libretexten, Libretexte, 5. Juni 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Autoprotolyse eau" von CDang - eigene Arbeit (Public Domain) über Commons Wikimedia


