Unterschied zwischen Benzol und Phenyl
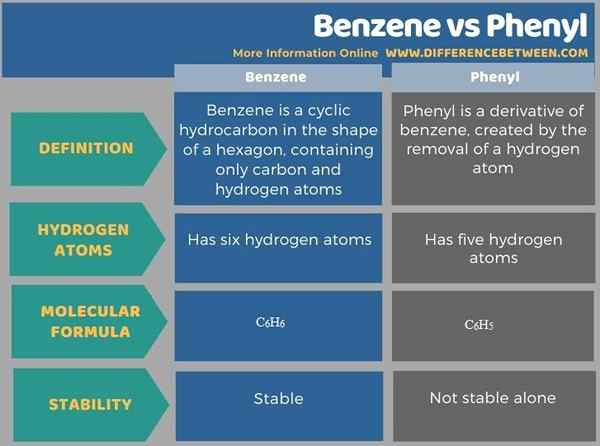
Der Schlüsselunterschied Zwischen Benzol und Phenyl ist das Benzol ist ein zyklischer Kohlenwasserstoff in Form eines Sechsecks, das nur Kohlenstoff- und Wasserstoffatome enthält, während Phenyl ein Derivat von Benzol ist, das durch Entfernen eines Wasserstoffatoms erzeugt wird. Daher enthält Benzol sechs Wasserstoffatome, während Phenyl fünf Wasserstoffatome enthält.
Benzol ist das einfachste aromatische Kohlenwasserstoff und dient als Elternverbindung für zahlreiche wichtige aromatische Verbindungen. Phenyl ist ein Kohlenwasserstoffmolekül mit der Formel C6H5. Es ist tatsächlich ein Derivat von Benzol und hat daher ähnliche Eigenschaften wie Benzol.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Benzol
3. Was ist Phenyl
4. Seite an Seitenvergleich - Benzol gegen Phenyl in tabellarischer Form
5. Zusammenfassung
Was ist Benzol?
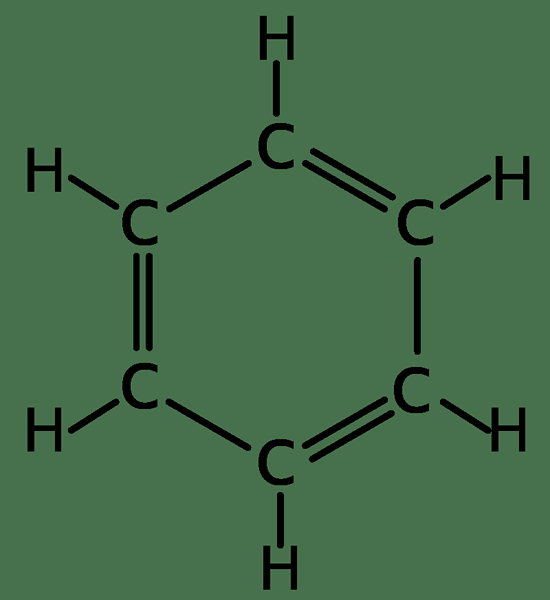
Benzol hat nur Kohlenstoff- und Wasserstoffatome angewendet, um eine planare Struktur zu ergeben. Es hat die molekulare Formel von C6H6. Die Benzolstruktur wurde von Kekule 1872 gefunden. Aufgrund der Aromatizität unterscheidet es sich von aliphatischen Verbindungen.

Seine Struktur und einige der Eigenschaften sind wie folgt.
Molekulargewicht: 78 g Mole-1
Siedepunkt: 80.1 ÖC
Schmelzpunkt: 5.5 ÖC
Dichte: 0.8765 g cm-3
Benzol ist eine farblose Flüssigkeit mit einem süßen Geruch. Es ist brennbar und verdunstet schnell, wenn sie freigelegt werden. Benzol wird als Lösungsmittel verwendet, weil es viele nichtpolare Verbindungen auflösen kann. Benzol ist jedoch im Wasser leicht löslich. Die Struktur von Benzol ist im Vergleich zu anderen aliphatischen Kohlenwasserstoffen einzigartig; Daher hat Benzol einzigartige Eigenschaften.
Alle Kohlenstoffe in Benzol haben drei SP2 Hybridisierte Orbitale. Zwei sp2 -hybridisierte Orbitale einer Kohlenstoffüberlappung mit SP2 hybridisierte Orbitale benachbarte Kohlenstoffe auf beiden Seiten. Andere sp2 Hybridisierte Orbital überlappt sich mit dem S -Orbital von Wasserstoff, um eine σ -Bindung zu bilden. Die Elektronen in P -Orbitalen einer Kohlenstoffüberlappung mit den P -Elektronen von Kohlenstoffatomen in beiden Seiten bilden PI -Bindungen. Diese Überlappung der Elektronen erfolgt in allen sechs Kohlenstoffatomen und erzeugt daher ein System von PI -Bindungen, die über den gesamten Kohlenstoffring verteilt sind. Somit sollen diese Elektronen delokalisiert werden. Die Delokalisierung der Elektronen bedeutet, dass es keine abwechselnden Doppel- und Einzelbindungen wechseln. Daher sind alle C-C-Bindungslängen gleich, und die Länge zwischen Einzel- und Doppelbindungslängen ist. Da der Delokalisierungsbenzolring stabil ist, zögert es, im Gegensatz zu anderen Alkenen Additionsreaktionen zu unterziehen.
Was ist Phenyl?
Phenyl ist ein Kohlenwasserstoffmolekül mit der Formel C6H5. Dies leitet sich von Benzol ab; Daher hat es ähnliche Eigenschaften wie Benzol. Dies unterscheidet sich jedoch von Benzol aufgrund des Mangels eines Wasserstoffatoms in einem Kohlenstoff. Daher beträgt das Molekulargewicht von Phenyl 77 g Mole-1. Phenyl wird als pH -Wert abgekürzt. Normalerweise ist Phenyl an eine andere Phenylgruppe, Atom oder Molekül gebunden (dieser Teil wird als Substituent bezeichnet).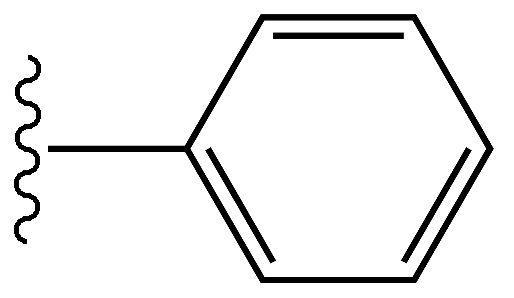
Die Kohlenstoffatome von Phenyl sind SP2 hybridisiert wie in Benzol. Alle Kohlenstoffe können drei Sigma -Bindungen bilden. Zwei der Sigma -Bindungen werden mit zwei benachbarten Kohlenstoffen gebildet, so dass es zu einer Ringstruktur führt. Die andere Sigma -Bindung wird mit einem Wasserstoffatom gebildet. In einem Kohlenstoff im Ring wird jedoch die dritte Sigma -Bindung eher mit einem anderen Atom oder Molekül als mit einem Wasserstoffatom gebildet. Die Elektronen in P -Orbitalen überlappen sich miteinander, um die delokalisierte Elektronenwolke zu bilden. Daher hat Phenyl ähnliche C-C-Bindungslängen zwischen allen Kohlenstoffen, unabhängig davon, ob es sich um wechselnde Einzel- und Doppelbindungen handelt. Diese C-C-Bindungslänge beträgt ungefähr 1.4 Å. Der Ring ist planar und hat einen Winkel von 120 ° C zwischen Bindungen um einen Kohlenstoff.
Aufgrund der Substituentengruppe von Phenyl, der Polarität und anderen chemischen oder physikalischen Eigenschaften ändern sich. Wenn der Substituent Elektronen an die delokalisierte Elektronenwolke des Rings spendet, werden diese als elektronendonierende Gruppen bezeichnet (e.G. -OCH3, NH2). Wenn der Substituent Elektronen aus der Elektronenwolke anzieht, ist es als Elektronen-With-Drawing-Substituent bekannt. (E.G. -NO2, -COOH). Phenylgruppen sind aufgrund ihrer Aromatizität stabil, sodass sie nicht leicht Oxidationen oder Reduktionen unterzogen werden. Darüber hinaus sind sie hydrophob und unpolar.
Was ist der Unterschied zwischen Benzol und Phenyl?
Grundsätzlich wird Phenyl von Benzol abgeleitet. Der Schlüsselunterschied zwischen Benzol und Phenyl besteht darin. Darüber hinaus ist die molekulare Formel von Benzol c6H6 Und für Phenyl ist es c6H5. Phenyl allein ist nicht so stabil wie Benzol.
Zusammenfassung -Benzol gegen Phenyl
Der Schlüsselunterschied zwischen Benzol und Phenyl besteht darin.
Bild mit freundlicher Genehmigung:
1. "Benzol Structural Diagramm" von Vladsinger - eigene Arbeit (Public Domain) über Commons Wikimedia
2. "Phenylradikale Gruppe" von Samuele Madini - eigene Arbeit (Public Domain) über Commons Wikimedia


