Unterschied zwischen Bohr und Rutherford Modell
Schlüsselunterschied - Bohr gegen Rutherford Modell
Das Konzept der Atome und ihrer Struktur wurde erstmals 1808 von John Dolton eingeführt. Er erklärte die Gesetze der chemischen Kombination, indem er Atome als unsichtbare Partikel ohne Struktur betrachtete. 1911 schlug der neuseeländische Physiker Ernest Rutherford vor, dass Atome aus zwei Komponenten bestehen: ein positiv geladener Kern in der Mitte des Atoms und negativ geladene Elektronen im extranuklearen Teil des Atoms. Einige von Maxwell präsentierte Theorien wie die elektromagnetische Theorie konnten nicht mit Rutherfords Modell erklärt werden. Aufgrund solcher Einschränkungen in Rutherfords Modell schlug der dänische Physiker Niels Bohr 1913 ein neues Modell vor. Bohrs Modell wurde größtenteils akzeptiert und er erhielt den Nobelpreis für seine Arbeit. Obwohl es weitgehend akzeptiert wurde, trägt es immer noch bestimmte Nachteile und Einschränkungen. Der Hauptunterschied zwischen dem Bohr -Modell und dem Rutherford -Modell besteht darin Im Modell des Rutherford -Modells können sich Elektronen in einer beliebigen Umlaufbahn um den Kern drehen, während im BOHR -Modell die Elektronen in einer bestimmten Hülle drehen können.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist das Bohr -Modell
3. Was ist das Rutherford -Modell
4. Nebenseitiger Vergleich - Bohr gegen Rutherford -Modell in tabellarischer Form
6. Zusammenfassung
Was ist das Bohr -Modell?
Das Modell von Bohr wurde 1922 von Niels Bohr vorgeschlagen, um die Struktur des Atoms zu erklären. In diesem Modell erwähnte Bohr, dass die meisten Atommasse im zentralen Kern liegt, der Protonen und Elektronen enthält. Das Modell schlug auch eine elektronische Konfiguration vor, die die Anordnung von Elektronen in kreisförmigen Umlaufbahnen erklärt, die als K, L, M, N usw. bezeichnet werden. Atome mit vollständigen Elektronenkonfigurationen sind nicht aktiv. Die Elektronenkonfiguration bestimmt die Reaktivität des Atoms.

Abbildung 01: BOHR -Modell
Das Bohr -Modell kann das Spektrum des Wasserstoffatoms erklären, kann jedoch nicht vollständig die Reaktivität von Multielektronenatomen erklären. Darüber hinaus erklärt es nicht den Zeeman -Effekt, bei dem jede spektrale Linie in Gegenwart eines externen Magnetfelds in mehr Linien aufgeteilt wird. In diesem Modell wird ein Elektron nur als Teilchen betrachtet. De Broglie, ein französischer Physiker, entdeckte jedoch, dass Elektronen sowohl Wellen- als auch Partikeleigenschaften haben. Später stellte ein Physiker ein weiteres Prinzip, das als Heisenbergs Unsicherheitsprinzip bezeichnet wird, die Unmöglichkeit der gleichzeitigen Bestimmung der genauen Position und der Impuls kleiner beweglicher Partikel wie Elektronen erläutert. Mit dieser Erfindung stand das Modell von Bohr vor einem schwerwiegenden Rückschlag.
Was ist das Rutherford -Modell?
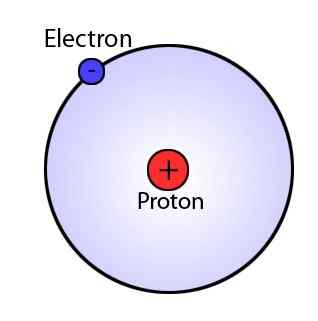
1911 schlug Ernest Rutherford Rutherfords Modell vor. Es besagt, dass das Atom (das Volumen) hauptsächlich aus Raum besteht und die Masse des Atoms im Kern zentriert ist, was der Kern des Atoms ist. Der Kern ist positiv geladen und der Elektronenumlaufbahn um den Kern. Die Umlaufbahnen haben keine bestimmten Wege. Da die Atome neutral sind, haben sie außerdem gleich positiv (im Kern) und negative Ladungen (Elektronen).

Abbildung 02: Rutherford Atom
Das Modell von Rutherford konnte die elektromagnetische Theorie, die Stabilität des Atoms und die Existenz bestimmter Linien im Wasserstoffspektrum nicht erklären.
Was ist der Unterschied zwischen Bohr und Rutherford Model?
Bohr gegen Rutherford Modell | |
| Das Bohr -Modell wurde 1922 von Niels Bohr vorgeschlagen. | Das Rutherford -Modell wurde 1911 von Ernest Rutherford vorgeschlagen. |
| Theorie | |
| Der größte Teil der Atommasse liegt im zentralen Kern, der Protonen enthält, und die Elektronen sind in bestimmten Energieniveaus oder Schalen angeordnet. | Der größte Teil des Atoms besteht aus leerem Raum. Das Zentrum des Atom. |
| Strahlungsemission von Elektronen | |
| Elektronen emittieren nur Wellen bestimmter Frequenzen. | Elektronen emittieren Wellen aller Frequenzen. |
| Elektronenemissionsspektrum | |
| Elektronenemissionsspektrum ist ein Leitungsspektrum. | Elektronenemissionsspektrum ist ein kontinuierliches Spektrum. |
Zusammenfassung -Bohr gegen Rutherford Modell
Sowohl Bohr- als auch Rutherford -Modelle sind planetarische Modelle, die die Atomstruktur bis zu einem gewissen Grad erklären. Diese Modelle haben Einschränkungen und erklären einige moderne Prinzipien der Physik nicht. Diese Modelle tragen jedoch stark zu modernen fortschrittlichen Modellen bei, die die Atomstruktur erklären. BOHR -Modell besagt, dass der größte Teil der Atommasse im zentralen Kern befindet, der Protonen enthält und dass Elektronen in bestimmten Energieniveaus oder Schalen angeordnet sind, was zu Elektronenlinienspektrum führt. Das Modell von Rutherford besagt, dass der größte Teil des Atoms aus einem leeren Raum besteht und die Mitte des Atom. Dies ist der Unterschied zwischen Bohr und Rutherford Model.
Laden Sie die PDF -Version des Bohr vs Rutherford -Modells herunter
Sie können die PDF -Version dieses Artikels herunterladen und ihn für Offline -Zwecke gemäß Zitatnotizen verwenden. Bitte laden Sie die PDF -Version hier den Unterschied zwischen BOHR und Rutherford -Modell herunter.
Verweise:
1. Tarendash, a. S. Lassen Sie uns überprüfen: Chemie, die physikalische Einstellung. Barrons Bildungsreihe, 2006. Drucken.
2. Warren, d. Chemiker in einem sozialen und historischen Kontext: Chemiker sind echte Menschen, die in der realen Welt leben. Royal Society of Chemistry, 2001. Drucken.
Bild mit freundlicher Genehmigung:
1. "Bohr -Modell" von JIA.Liu - eigene Arbeit (Public Domain) über Commons Wikimedia
2. "Rutherford Atom" von eigener Arbeit (Createjoder XD XD) (CC BY-SA 3.0) über Commons Wikimedia


