Unterschied zwischen Bindungsmoment und Dipolmoment
Schlüsselunterschied - Bindungsmoment gegen Dipolmoment
Die Begriffe Bond -Moment und Dipolmoment basieren auf ähnlichen Prinzipien, unterscheiden sich jedoch auf der Grundlage der Anwendung. Das Bond -Moment ist auch als Bond -Dipolmoment bekannt. Es ist die Polarität einer chemischen Bindung, die sich in einem bestimmten Molekül befindet. Das Dipolmoment hingegen ist jede Art von elektrischer Trennung (Trennung von Ladungen). Der Hauptunterschied zwischen Bindungsmoment und Dipolmoment ist das Das Bindungsmoment tritt in einer kovalenten chemischen Bindung auf, während ein Dipolmoment zwischen zwei Ionen in einer ionischen Bindung oder zwischen zwei Atomen in einer kovalenten Bindung auftritt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Bond -Moment
3. Was ist Dipolmoment
4. Ähnlichkeiten zwischen Bindungsmoment und Dipolmoment
5. Seite für Seitenvergleich - Bindungsmoment gegen Dipolmoment in tabellarischer Form
6. Zusammenfassung
Was ist Bond -Moment?
Bindungsmoment ist die Trennung von elektrischen Ladungen in einer kovalenten chemischen Bindung, die in einer bestimmten chemischen Verbindung vorhanden ist. Daher gibt es die Polarität einer chemischen Bindung. Das Bindungsmoment tritt auf, wenn eine chemische Bindung eine positive und negative Ladungstrennung vorliegt. Das Bond -Dipolmoment wird durch das Symbol „μ“ bezeichnet.
μ = ΔD
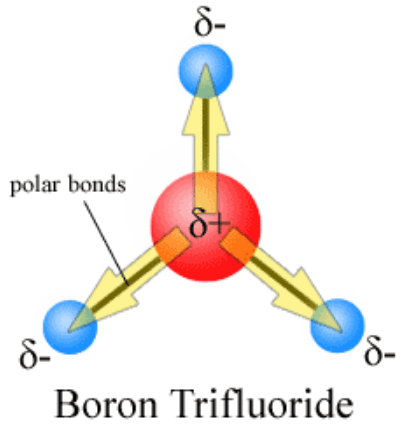
In diesem ist δ der Wert der Ladung und d ist der Abstand zwischen zwei Atomen in der kovalenten Bindung. Bei der Schaffung eines Bindungsdipolmoments werden die elektrischen Ladungen als Teilladungen δ+ und δ getrennt-. Diese Ladungstrennung tritt in chemischen Bindungen auf, wenn zwei an der Bindungsbildung beteiligte Atome unterschiedliche Elektronegativitätswerte aufweisen. Da die Elektronegativität eines Atoms die Affinität zu Elektronen ist, ziehen mehr elektronegative Atome Bindungselektronen zu sich an. Dann erhält das Atom mit einem weniger elektronegativen Wert eine teilweise positive Ladung, da die Dichte der Elektronen um dieses Atom geringer ist. Entsprechend erhält das Atom mit einer hohen Elektronegativität eine teilweise negative Ladung.

Abbildung 1: Polarität von Bor Trifluorid (BF3)
Die SI-Einheit für die Messung des Bond-Dipolmoments ist Coulomb-Meter (C m). Ein Diatommolekül hat nur eine kovalente Bindung. Daher ähnelt das Bond -Dipolmoment eines Diatommoleküls dem molekularen Dipolmoment. Das molekulare Dipolmoment für Diatommoleküle, die zwei ähnliche Atome enthalten, ist Null, i.e., das molekulare Dipolmoment von CL2 ist Null. Aber hoch ionische Verbindungen wie KBR haben ein hohes Bindungsmoment und ein molekulares Moment. Für komplexe polyatomische Moleküle gibt es viele kovalente Bindungen. Dann wird das molekulare Dipolmoment durch alle einzelnen Bindungsdipolmomente bestimmt.
Was ist Dipolmoment?
Das Dipolmoment ist die Trennung von elektrischen Ladungen. Die Ladungstrennung kann zwischen zwei Ionen in einer ionischen Bindung oder zwei Atomen in einer kovalenten chemischen Bindung stattfinden. Ein Dipolmoment ergibt sich aus Unterschieden zwischen den Elektronegativitätswerten verschiedener Atome, die chemische Bindungen bilden. Je größer die Differenz zwischen den Elektronegativitätswerten ist, ist das Dipolmoment größer. Das Dipolmoment misst die Polarität eines Moleküls. Das Dipolmoment eines Moleküls wird unter Verwendung der folgenden Gleichung berechnet.
μ = σq.R
wobei μ das Dipolmoment ist, q ist die Ladungsgröße und R die Ladungsposition. Hier sind μ und R Vektoren, die Größen mit einer Richtung sowie einer Größe haben.
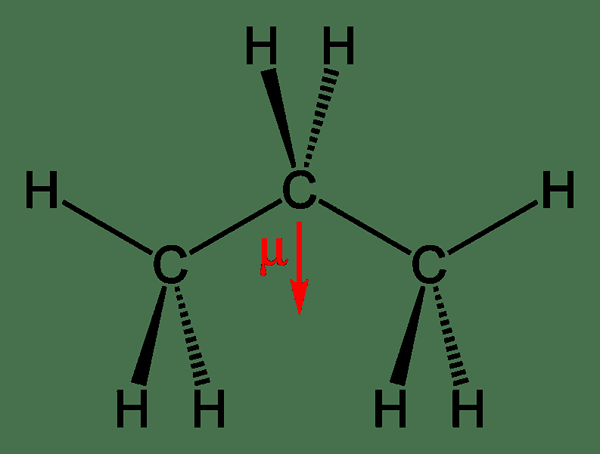
Abbildung 2: Dipolmoment von Propan
Aber manchmal wird der Begriff Dipolmoment verwendet, um das Maß für die magnetische Polarität eines Ladesystems zu nennen. Das magnetische Dipolmoment bestimmt das Drehmoment, das ein Magnet in einem externen Magnetfeld erfährt. (Drehmoment = Moment; eine Rotationskraft).
Was sind die Ähnlichkeiten Bindungsmoment und Dipolmoment?
- Beide werden verwendet, um die Polarität zu messen (die aufgrund der Ladungsetrennung erzeugt wird)
- Beide werden im Einheits-Debye (D) gemessen, der gleichzeitig mit Coulomb-Meter (C m) entspricht.
Was ist der Unterschied zwischen Bindungsmoment und Dipolmoment?
Bond -Moment gegen Dipolmoment | |
| Bindungsmoment ist die Trennung von elektrischen Ladungen in einer kovalenten chemischen Bindung, die in einer bestimmten chemischen Verbindung vorhanden ist. | Das Dipolmoment ist die Trennung von elektrischen Ladungen. |
| Messung | |
| Bindungsmoment misst die Polarität einer chemischen Bindung. | Das Dipolmoment misst die Polarität einer chemischen Bindung oder eines Moleküls. |
| Auftreten | |
| Bindungsmoment tritt in einer kovalenten chemischen Bindung auf. | Das Dipolmoment tritt zwischen zwei Ionen in einer ionischen Bindung oder zwischen zwei Atomen in einer kovalenten Bindung in einem Molekül auf. |
Zusammenfassung - Bond -Moment gegen Dipolmoment
Bindungsmoment und Dipolmoment sind verwandte Begriffe, wenn es um die Polarität chemischer Bindungen in Molekülen oder ionischen Verbindungen geht. Der Schlüsselunterschied zwischen Bindungsmoment und Dipolmoment besteht darin.
Referenz:
1. „Dipolmomente.Chemie -Libretexten, Libretexten, 16. Januar. 2018, hier erhältlich.
2. „Bond Dipol Moment.Wikipedia, Wikimedia Foundation, 11. März. 2018, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Polarity Boron Trifluorid" von Emma Farmer (Seerephine bei English Wikipedia) - Erstellt mit Adobe Photoshop von Emma Farmer (Public Domain) über Commons Wikimedia
2. "Propan-Dipole-moment-2d" von Ben Mills-eigene Arbeit (Public Domain) über Commons Wikimedia


