Differenz zwischen Kalziumchlorid und Magnesiumchlorid

Der Schlüsselunterschied Zwischen Calciumchlorid und Magnesiumchlorid ist das Das Calciumchlorid enthält ein Kalziumkation mit zwei Chloridanionen, während das Magnesiumchlorid ein Magnesiumkation mit zwei Chloridanionen enthält.
Sowohl Calciumchlorid als auch Magnesiumchlorid sind Salzverbindungen, die Kationen und Anionen enthalten. Dies sind Feststoffe bei Raumtemperatur, die in Wasser sehr löslich sind. Darüber hinaus werden beide zur Staubkontrolle verwendet. Lassen Sie uns weitere Details darüber sprechen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Calciumchlorid
3. Was ist Magnesiumchlorid
4. Seite für Seitenvergleich - Calciumchlorid gegen Magnesiumchlorid in tabellarischer Form
5. Zusammenfassung
Was ist Calciumchlorid?
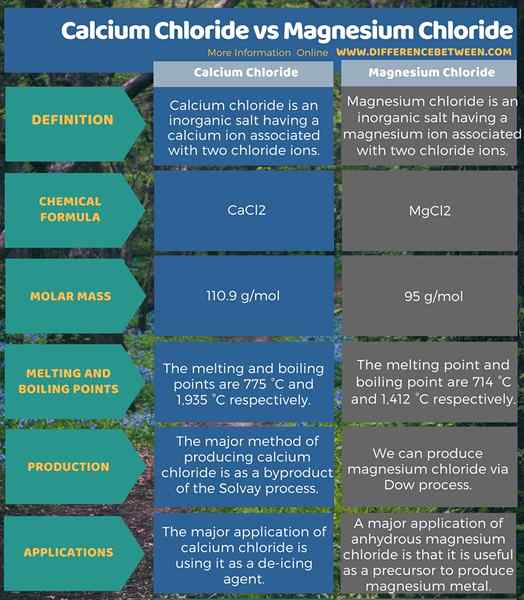
Calciumchlorid ist ein anorganisches Salz mit einem Calciumionen mit zwei Chloridionen, die assoziiert sind. Die chemische Formel dieser Verbindung ist CaCl2. Die Molmasse beträgt 110.9 g/mol. Bei Raumtemperatur existiert es als kristalliner weißer Feststoff. Darüber hinaus ist es hygroskopisch und löst sich leicht in Wasser auf. Deshalb können wir es als Trockenmittel verwenden. Es ist entweder als wasserfreie Form oder als hydratisierte Formen erhältlich. Die Schmelz- und Siedepunkte des wasserfreien Calciumchlorids betragen 775 ° C bzw. 1.935 ° C. Die Hauptmethode zur Herstellung von Kalziumchlorid ist ein Nebenprodukt des Solvay -Prozesses. Es verwendet Kalkstein.
2 NaCl + Caco3 → na2CO3 + CaCl2
Eine der Hauptanwendungen dieser Verbindung ist als Enteisungsmittel. Es entzieht sich durch den deprimierenden Gefrierpunkt des Wassers.

Abbildung 01: Calciumchloridkristalle
Die zweitgrößte Anwendung ist, dass sie als Staubkontrollmittel verwendet wird. Aufgrund seiner hygroskopischen Eigenschaften kann eine konzentrierte Lösung eine flüssige Schicht auf dem Schmutz der Oberfläche einer Straße halten. Daher kontrolliert es den Staub. Darüber hinaus kann es die Wasserhärte erhöhen. Beispiel: Erhöhung der Wasserhärte in Schwimmbädern.
Was ist Magnesiumchlorid?
Magnesiumchlorid ist ein anorganisches Salz mit einem Magnesiumionen, das mit zwei Chloridionen assoziiert ist. Die chemische Formel dieser Verbindung ist MGCL2. Die Molmasse beträgt 95 g/mol. Der Schmelzpunkt und die Siedepunkte betragen 714 ° C bzw. 1.412 ° C. Bei Raumtemperatur existiert es als weißer oder farbloser kristalline Feststoff. Es ist sehr wasserlöslich und ist auch in hydratisierten Formen erhältlich. Wir können die Hydratform aus Sole oder Meerwasser extrahieren. Es gibt mehrere Hydrate dieser Verbindung, die 2, 4, 6, 8 oder 12 Wassermoleküle enthalten. Diese Hydraten verlieren diese Wassermoleküle beim Erhitzen. Wir können diese Verbindung über den Dow -Prozess produzieren. Dort regeneriert Magnesiumchlorid bei der Reaktion mit Salzsäure aus Magnesiumhydroxid.
Mg (OH)2(S) + 2 HCl → MGCL2 (aq) + 2 h2Ö(l)
Eine wichtige Anwendung von wasserfreiem Magnesiumchlorid ist, dass es als Vorläufer nützlich ist, um Magnesiummetall zu produzieren.

Abbildung 02: Magnesiumchloridkristalle
Wir können dieses Metall über die Elektrolyse von MGCL2 produzieren. Darüber hinaus können wir diese Verbindung für Staubkontrollierung, feste Stabilisierung, Wind -Erosionsminderung usw. verwenden. Als weitere Bedeutung verwenden wir MGCL2 als Katalysatorunterstützung für den Ziegler-Natta-Katalysator.
Was ist der Unterschied zwischen Calciumchlorid und Magnesiumchlorid?
Calciumchlorid ist ein anorganisches Salz mit einem Calciumionen mit zwei Chloridionen, die assoziiert sind. Daher ist die chemische Formel dieser Verbindung CaCl2. Seine Molmasse beträgt 110.9 g/mol. Darüber hinaus betragen die Schmelz- und Siedepunkte des wasserfreien Calciumchlorids 775 ° C bzw. 1.935 ° C. Magnesiumchlorid ist ein anorganisches Salz mit einem Magnesiumionen, das mit zwei Chloridionen assoziiert ist. Daher ist die chemische Formel dieser Verbindung MGCL2. Seine Molmasse beträgt 95 g/mol. Darüber hinaus betragen der Schmelzpunkt und der Siedepunkt des wasserfreien Magnesiumchlorids 714 ° C bzw. 1.412 ° C. Diese Verbindungen haben unterschiedliche Anwendungen, aber eines gemeinsam; Beide sind wichtige Staubkontrollmittel.
Zusammenfassung -Calciumchlorid gegen Magnesiumchlorid
Sowohl Calcium als auch Magnesiumchlorid sind als Staubkontrollmittel wichtig. Die Differenz zwischen Calciumchlorid und Magnesiumchlorid besteht darin.
Referenz:
1. "Calciumchlorid.Wikipedia, Wikimedia Foundation, 23. Juli 2018. Hier verfügbar
2. "Magnesiumchlorid.Nationales Zentrum für Biotechnologieinformationen. Pubchem Compound -Datenbank, u.S. Nationalbibliothek für Medizin. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Calciumchlorid CACl2'By Kein maschinelles Lesbarer Autor zur Verfügung gestellt. (CC BY-SA 3.0) über Commons Wikimedia
2."Magnesiumchlorid" (Public Domain) über Commons Wikimedia


