Differenz zwischen Calciumlactat und Calciumcarbonat
Der Schlüsselunterschied Zwischen Calciumlactat und Calciumcarbonat befindet sich die Calciumlactat enthält zwei Laktationen für jedes Calciumion, während das Calciumcarbonat ein Carbonation pro Calciumion enthält. Darüber hinaus unterscheiden sich beide auch in der Anwendung.
Sowohl Calciumlactat als auch Calciumcarbonat sind anorganische Salze. Beide Verbindungen sind als Kalziumpräparate nützlich, um niedrige Kalziumspiegel für Menschen zu behandeln, die nicht genügend Kalzium aus ihrer Ernährung erhalten. Lassen Sie uns weitere Details zu diesen Verbindungen diskutieren und dadurch die Differenz zwischen Calciumlactat und Calciumcarbonat unterscheiden.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Calciumlaktat
3. Was ist Calciumcarbonat
4. Seite an Seite Vergleich - Calciumlactat gegen Calciumcarbonat in tabellarischer Form
5. Zusammenfassung
Was ist Calciumlaktat?
Calciumlaktat ist ein anorganisches Salz mit der chemischen Formel C6H10Cao6. Es enthält zwei Laktationen pro Kalziumkation. Die Molmasse ist 218.22 g/mol, und es erscheint als weißes oder cremesweißes Pulver. Sein Schmelzpunkt beträgt 240 ° C. Darüber hinaus hat das Laktatanion Chiralität; So hat es d und l Isomere. Normalerweise synthetisieren und metabolisieren lebende Organismen das L -Isomer. Einige Bakterien können jedoch auch das D -Isomer synthetisieren. Darüber hinaus bildet diese Verbindung mehrere Hydrate; Das häufigste Hydrat ist die Pentahydratform.
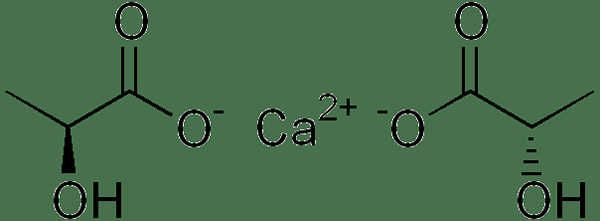
Abbildung 01: Chemische Struktur von Calciumlaktat
Wir können Calciumlactat über die Reaktion von Milchsäure mit Calciumcarbonat (oder Calciumhydroxid) produzieren. In der Produktion in der Industrie im Bereich der häufigsten Produktionsstrategie ist die Fermentation von Kohlenhydraten in Gegenwart von Calciumcarbonat oder Hydroxid.
Die Hauptanwendungen dieser Verbindung sind in der Medizin; Es wird als Antacidum verwendet. Darüber hinaus ist es nützlich, Hypokalkämie zu behandeln (der medizinische Begriff für Calciummangel). Wir müssen diese Verbindung nicht mit Nahrung nehmen, weil unser Körper diese Verbindung bei verschiedenen pH -Werten absorbieren kann. Darüber hinaus finden wir diese Verbindung auch in verschiedenen Mundwasser.
Was ist Calciumcarbonat?
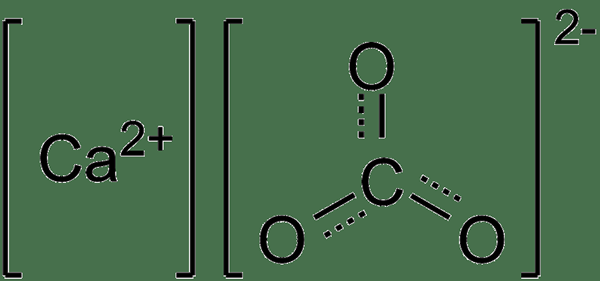
Calciumcarbonat ist ein anorganisches Salz mit der chemischen Formel Caco3. Daher enthält es ein Carbonatanion pro Kalziumkation. Die Molmasse beträgt 100 g/mol und erscheint als feines weißes Pulver mit einem kalkhaltigen Geschmack. Der Schmelzpunkt beträgt 1.339 ° C und hat keinen Siedepunkt, da er bei hohen Temperaturen eine Zersetzung unterzogen wird.
Bei der Betrachtung des Auftretens dieses Salzes existiert es in der Erdkruste als Calciummineralien wie Calcit, Aragonit usw. usw. Eierschalen, Schneckenschalen und Meerschalen sind die biologischen Quellen. Darüber hinaus können wir diese Verbindung über Bergbau oder Steinbruch vorbereiten, das Mineral, das oben genannt wird. Alternativ können wir es durch reagierende Calciumoxid mit Wasser produzieren. Dies gibt Calciumhydroxid. Anschließend müssen wir Kohlendioxid durch dieses Produkt durchlaufen, um Calciumcarbonat zu erhalten.

Abbildung 02: Chemische Struktur von Calciumcarbonat
Die Hauptanwendungen dieser Verbindung liegen hauptsächlich in der Bauindustrie, wo sie als Baumaterial wichtig ist. Daher ist es eine häufige Zutat im Zement. Darüber hinaus ist es die Hauptkomponente in der Blackboard -Kreide. Es gibt auch Gesundheits- und Ernährungsanwendungen. Es ist eine kostengünstige Nahrungsergänzungsmittel. Darüber hinaus können wir es als Phosphatbindemittel zur Behandlung von Hyperphosphatämie verwenden. Abgesehen davon ist es als Füllstoff für Tablets in der Pharmaindustrie nützlich.
Was ist der Unterschied zwischen Calciumlactat und Calciumcarbonat?
Calciumlaktat ist ein anorganisches Salz mit der chemischen Formel C6H10Cao6. Es enthält zwei Laktationen für jedes Kalziumion. Unter wichtigen chemischen Daten beträgt die Molmasse dieser Verbindung 218.22 g/mol und der Schmelzpunkt beträgt 240 ° C. Darüber hinaus ist Calcium -Laktat als Antazida nützlich, um Hypokalkämie als Zutat in Mundwäschen und auch als Lebensmittelzusatzin zu behandeln. Calciumcarbonat hingegen ist ein anorganisches Salz mit der chemischen Formel Caco3. Es enthält ein Carbonation pro Kalziumion. Die Molmasse beträgt 100 g/mol und der Schmelzpunkt beträgt 1.339 ° C. Darüber hinaus ist es als Baustoff als Blackboard -Kreide als kostengünstige Nahrungsergänzung usw. nützlich. Die folgende Infografik enthält weitere Einzelheiten zu der Differenz zwischen Calciumlactat und Cacalciumcarbonat.
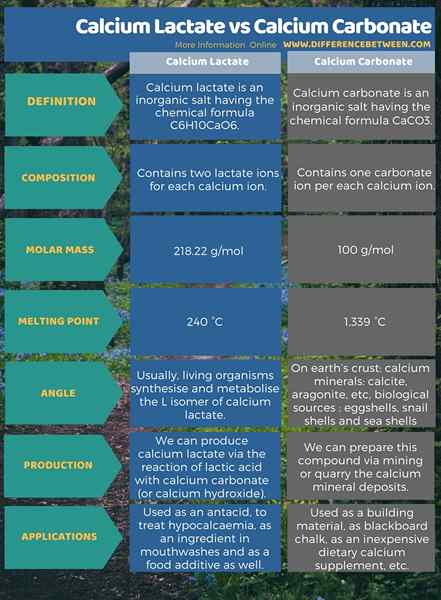
Zusammenfassung -Calciumlactat gegen Calciumcarbonat
Sowohl Calciumlactat als auch Calciumcarbonat sind anorganische Salze von Calcium. Die Differenz zwischen Calciumlactat und Calciumcarbonat besteht darin.
Referenz:
1. „Calcium Lactat oral: Verwendungen, Nebenwirkungen, Wechselwirkungen, Bilder, Warnungen und Dosierung.”WebMD, WebMD. Hier verfügbar
2. "Kalziumkarbonat.Wikipedia, Wikimedia Foundation, 27. Juli 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Calcium Lactate'By Edgar181 - eigene Arbeit, (Public Domain) über Commons Wikimedia
2.'Calciumcarbonat'by Edgar181 (Diskussion) - eigene Arbeit, (Public Domain) über Commons Wikimedia


