Unterschied zwischen Carbokation und Carbanion
Carbocation gegen Carbanion
Der Schlüsselunterschied Zwischen Carbocation und Carboanion liegt ihre Gebühren; Sie sind beide organische molekulare Spezies mit entgegengesetzten Ladungen. Carbocation ist positiv aufgeladen und Carboanion ist negativ aufgeladen. Ihre Stabilität hängt von mehreren Faktoren ab, und einige von ihnen sind sehr wichtig für die Synthese anderer chemischer Verbindungen.
Was ist Carbokation
Eine Carbokation ist eine chemische Spezies, die eine positive Ladung für ein Kohlenstoffatom hat. Sein Name gibt die klare Vorstellung davon, dass es a ist Kation (ein positives Ion) und das Wort carbo bezieht sich auf ein Kohlenstoffatom. Carbocation umfasst verschiedene Kategorien; Primärkarbokation, Sekundärkarbokation und tertiärer Carbokation. Sie werden gemäß der Anzahl der Alkylgruppen klassifiziert, die an das positiv geladene Kohlenstoffatom gebunden sind. Ihre Stabilität und die Reaktivität variieren je nach diesen Substituenten.

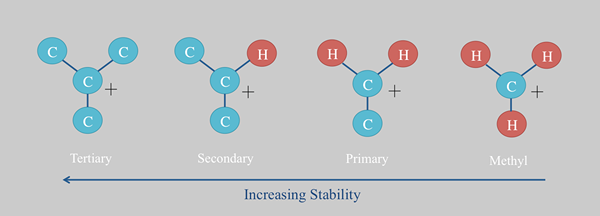
Carbocation Stability Trend
Was ist Carbanion
Ein Carboanion ist eine organische molekulare Spezies mit einer negativen elektrischen Ladung auf einem Kohlenstoffatom. Mit anderen Worten, es ist ein Anion, bei dem ein Kohlenstoffatom ein ungesandes Elektronenpaar mit drei Substituenten besitzt. Die Gesamtzahl der Valenzelektronen entspricht acht. Sie werden gebildet, indem positiv geladene Gruppen oder Atome aus einem neutralen Molekül entfernt werden. Sie sind als chemische Zwischenprodukte sehr wichtig, um andere Substanzen wie Kunststoffe und Polyethen (oder Polyethylen) zu synthetisieren. Das kleinste Carbanoin ist 'Methide -Ion' (CH3-); aus Methan gebildet (ch4) durch den Verlust eines Protons (h-).

Was ist der Unterschied zwischen Carbokation und Carbanion?
Merkmale von Carbokation und Carbanion
Carbokation: Carbocation ist sp2 Hybridisiert und das leer stehende P-Orbital liegt senkrecht zur Ebene von drei substituierten Gruppen. Daher hat es eine trigonale planare molekulare Struktur. Die Carbokation erfordert ein Elektronenpaar, um das Oktett zu vervollständigen. Sie können mit Nucleophilen reagieren, von einem PI-Bindungen deprotoniert werden und können in derselben Spezies Neuarrangements haben.
Carbanion: Ein Alkyl -Carboanion hat drei Bindungspaare und ein einsames Paar; Seine Hybridisierung ist also SP3, und die Geometrie ist pyramiden. Die Geometrie von Allyl- oder Benzyl -Carboanion ist planar, und die Hybridisierung ist SP2. Das Oktett ist vollständig in der äußersten Umlaufbahn eines carbanionischen Kohlenstoffatoms und verhält sich als Nucleophil, um mit Elektrophilen zu reagieren.
Stabilität:
Carbokation: Die Carbokationsstabilität hängt von verschiedenen Faktoren ab. Es ist stabiler, wenn mehr -r -Gruppen am positiven Kohlenstoffatom angeschlossen sind. Daher ist die tertiäre Carbokation vergleichsweise stabil als primäre. 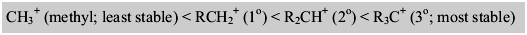 Resonanzstrukturen erhöhen auch die Stabilität.
Resonanzstrukturen erhöhen auch die Stabilität.
Carbanion: Die Stabilität von Carboanion hängt von mehreren Faktoren ab. Elektronegativität von carbanionischen Kohlenstoff, Resonanzeffekt, induktiver Effekt, die durch angeschlossene Substituenten und Stabilisierung durch> C = O-, -no2- und CN -Gruppen verursacht werden, die auf carbanionischen Kohlenstoff vorhanden sind
Definitionen:
Induktionseffekt: Es kann experimentell beobachtbar sein, dass die Ladungsübertragung durch eine Atomekette in einem Molekül übertragbar ist, was zu einem dauerhaften Dipol in einer Bindung führt.
Beispiele für Carbokation und Carbanion
Carbokation:
Primärkarbokation: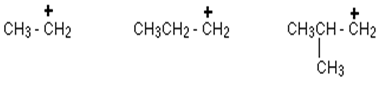
In einer primären (1 °) Carbokation ist das positiv geladene Kohlenstoffatom nur an eine Alkylgruppe und zwei Wasserstoffatome befestigt.
Sekundäre Carbokation: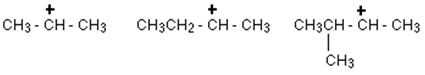
In einer sekundären (2 °) Carbokation ist das positiv geladene Kohlenstoffatom an zwei andere Alkylgruppen (die gleich oder unterschiedlich sein können) und an einem Wasserstoffatom befestigt.
Tertiäre Carbokation: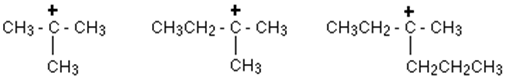
In einer tertiären (3 °) Carbokation ist das positive Kohlenstoffatom an drei Alkylgruppen angebracht (die eine Kombination vonselben oder unterschiedlich sein können), jedoch keine Wasserstoffatome.
Carbanion:
Carboanion wird ebenfalls in drei Kategorien eingeteilt wie in der Carbocation Primär -Carbanion, Sekundärer Carbanion und Tertiär -Carbanion. Dies wird auch basierend auf der Anzahl der an das anionischen Kohlenstoffatom angeschlossenen -r -Gruppen durchgeführt. 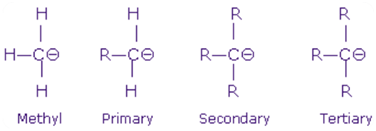
Verweise:
„Carbocation.”Wikipedia. Zugriff auf den 09. Juni 2016. von hier „Carbokationen (oder Carboniumionen).Chemguide. Zugriff auf den 09. Juni 2016. von hier "Carbocations". Tutorials für Organizemie. Zugriff auf den 09. Juni 2016. von hier Bild mit freundlicher Genehmigung: "Carbocation Stability Trend" von AlatleePhillips - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia "Carbanion -Strukturformeln V" von Jü - eigener Arbeit (CC0) über Commons Wikimedia

