Unterschied zwischen Chromsäure und Chromtrioxid

Der Schlüsselunterschied Zwischen Chromsäure und Chromtrioxid ist das Chromsäure ist eine stark saure Lösung, die durch Kombination konzentrierter Schwefelsäure mit Dichromat hergestellt wird, während Chromtrioxid das saure Anhydrid von Chromsäure ist.
Chromsäure und Chromtrioxid sind zwei verwandte Substanzen; Chromsäure kann aus der Hydratation von Chromtrioxid hergestellt werden. Dies sind anorganische Substanzen, die chemisches Chromelement enthalten.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Chromsäure
3. Was ist Chrom -Trioxid
4. Seite für Seitenvergleich - Chromsäure gegen Chromtrioxid in tabellarischer Form
5. Zusammenfassung
Was ist Chromsäure?
Chromsäure ist eine stark saure Lösung, die H2CRO4 -Moleküle enthält. Diese Säure wird jedoch normalerweise aus der Kombination aus konzentrierter Schwefelsäure und Dichromat hergestellt. Daher kann diese Säure eine Vielzahl von Verbindungen enthalten, einschließlich fester Chromtrioxid. Diese starke Säure ist nützlich für das Reinigen von Glasmaterial. Das Chromatom in der Molekularschromsäure befindet sich im Oxidationszustand von +6. Diese Säure wird als starke und hochkarrosive Säure angesehen.
Im Allgemeinen kann Chromsäure als dunkelrote Kristalle beobachtet werden. Die Molekularchromsäure weist häufig Merkmale mit Schwefelsäuremolekülen auf. Sie haben ähnliche Deprotonierungsmuster und saure Stärken.
Chromsäure ist ein wichtiges Oxidationsmittel und kann organische Verbindungen wie Alkohole zu Carboxylsäuren und Ketonen, primären und sekundären Alkoholen in entsprechende Aldehyde und Ketone usw. oxidieren.

Abbildung 01: Chromsäure
Bei der Betrachtung der Verwendungen dieser starken Säure ist es als Zwischenprodukt im Chrombeschichtung wichtig, das in der Keramikglasur und des farbigen Glass als starkes Oxidationsmittel nützlich ist, das für die Reinigung von Laborglaswaren in der Reparaturindustrie der Musikinstrumenten aufgrund seiner nützlich ist Fähigkeit, Messingmaterial aufzuhellen, nützlich bei der Herstellung von Haarfarbstoffen, als Bleichmittel in der schwarz -weißen fotografischen Umkehrverarbeitung usw.
Was ist Chrom -Trioxid?
Chrom -Trioxid ist eine anorganische Verbindung mit der chemischen Formel CRO3. Es ist die saure wassere Form von Chromsäure. Daher sind diese beiden Substanzen manchmal auf dem Markt unter demselben Namen erhältlich. Wir können diese Substanz als dunkle, lilafarbene Feststoff unter ihrem wasserfreien Zustand beobachten, und wenn die Substanz hydratisiert ist, erscheint sie in orange Farbe. Diese Substanz wird hauptsächlich für Elektroplattenprozesse hergestellt. Darüber hinaus ist Chrom -Trioxid ein sehr starker Oxidationsmittel. Daher ist es auch ein Karzinogen.

Abbildung 02: Nass -Chrom -Trioxid
Zusätzlich zum Chrombeschichtungsprozess gibt es andere Verwendungen von Chrom -Trioxid wie die Erzeugung von passivierten Chromatfilmen, die gegen Korrosion resistent sind und bei der Produktion von synthetischen Rubinen nützlich sind, um Arten von anodischer Beschichtung auf Aluminium usw. anzuwenden, usw.
Was ist der Unterschied zwischen Chromsäure und Chromtrioxid?
Chromsäure ist eine stark saure Lösung, die H2CRO4 -Moleküle enthält. Chrom -Trioxid ist eine anorganische Verbindung mit der chemischen Formel CRO3. Chromsäure und Chromtrioxid sind anorganische Verbindungen. Der Schlüsselunterschied zwischen Chromsäure und Chromtrioxid besteht darin, dass Chromsäure eine stark saure Lösung ist.
Nachfolgend Infografik listet mehr Unterschiede zwischen Chromsäure und Chromtrioxid auf.
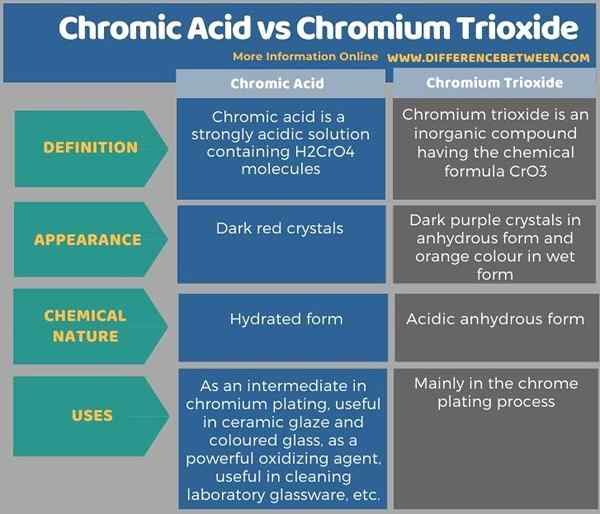
Zusammenfassung -Chromsäure gegen Chrom -Trioxid
Chrom kann durch die Hydratation von Chromtrioxid hergestellt werden. Der Schlüsselunterschied zwischen Chromsäure und Chromtrioxid besteht darin, dass Chromsäure eine stark saure Lösung ist.
Referenz:
1. „Oxidation durch Chromsäure.” Chemie -Libretexten, 13. September. 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Chromic-Sacid-Photo" von Himstakan-eigener Arbeit (CC BY-SA 4.0) über Commons Wikimedia
2. "Reaktion zwischen Kaliumdichromat und Schwefelsäure (1)" durch Rando Tuvike - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia


