Unterschied zwischen Chrom und Hexavalent Chrom

Der Schlüsselunterschied Zwischen Chrom und Hexavalent Chrom ist das Chrom ist ein chemisches Element, während hexavalentes Chrom jede Verbindung mit Chrom in seinem +6 Oxidationszustand ist.
Chrom ist ein Metall, das bei der Herstellung von Legierungen sehr nützlich ist. Der Begriff hexavalenter Chrom bezieht sich auf Verbindungen, die Chrom enthalten. Das Metall tritt im +6 Oxidationszustand auf. Dies bedeutet daher, dass die hexavalente Chromverbindung Chromatome aufweist, die 6 Elektronen aus den äußersten Orbitalen entfernt haben.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Chrom
3. Was ist hexavalentes Chrom
4. Seite an Seitenvergleich - Chrom gegen hexavalente Chrom in tabellarischer Form
5. Zusammenfassung
Was ist Chrom?
Chrom ist ein chemisches Element mit Atomzahl 24. Es ist ein Metall mit einem silbrigen metallischen Aussehen. Darüber hinaus ist dieses Element das erste chemische Element der Gruppe 6 in der Periodenzüchtertabelle. Wir können es als Übergangsmetall kategorisieren. Es ist schwer, aber spröde. Es ist wichtig als Hauptadditiv für Eisenlegierungen wie Edelstahl. Darüber hinaus sind die Hauptmerkmale, die ihren hohen Wert verursachen. Einige chemische Eigenschaften von Chrom sind wie folgt:
• Das Symbol ist Cr.
• Ein D-Block-Element
• Die Elektronenkonfiguration ist [AR] 3D54S1
• existiert in der festen Phase bei Standardtemperatur und Druck
• Der Schmelzpunkt ist 1907 ° C
• Der Siedepunkt ist 2671 ° C
• Die Dichte ist ungefähr siebenmal mehr als die Wasserdichte
• Die gemeinsamen Oxidationszustände sind +3 und +6
• Ein starkes Oxidationsmittel im Vergleich zu Molybdän- und Wolframoxiden

Abbildung 01: Chromgelb
Einige wichtige physikalische Eigenschaften sind wie folgt:
• extrem hart
• Kann Quarzproben aufgrund hoher Härte kratzen
• Hoher Widerstand gegen die Tarnishing
• Ungewöhnlich hohe Spiegelreflexion
• Antiferromagnetische Ordnung bei Raumtemperatur (über 38 ° C ist es paramagnetisch)
• Durch Oxidation passivieren, wenn das Metall normaler Luft ausgesetzt ist
Bei der Betrachtung der Verwendung von Chrom ist es eine wichtige Komponente in Edelstahl, die für Oberflächenbeschichtungszwecke, als gelbe Pigmente, Chromoxide als grüne Pigmente, die Konservierung von Holz (Chrom +6 Salz) usw. nützlich ist, nützlich ist.
Was ist hexavalentes Chrom?
Hexavalent -Chrom ist jede Verbindung, die Chrom im +6 Oxidationszustand enthält. Normalerweise erhalten wir die hexavalente Form von Chrom aus dem Chromerz. Es gibt jedoch auch andere hexavalente Verbindungen wie Chrom -Trioxid.

Abbildung 2: Chrom -Trioxid
Darüber hinaus sind diese Verbindungen in der Textilindustrie als Farbstoffe wichtig, wichtig für die Holzerhaltung, als Komponenten in Antikorrosionsprodukten, Komponenten in Farben usw. Diese hexavalenten Verbindungen sind jedoch toxisch und als menschliche Karzinogene angesehen. Es liegt daran, dass die Struktur des hexavalenten Chroms dem Sulfat ähnlich ist; So transportiert es leicht über Sulfatkanäle in Zellen.
Was ist der Unterschied zwischen Chrom und Hexavalent Chrom?
Chrom ist ein chemisches Element mit Atomzahl 24. Der Schlüsselunterschied zwischen Chrom und hexavalentem Chrom besteht darin.
Darüber hinaus können wir Chrom als CR symbolisieren, aber das Symbol für hexavalentes Chrom ist Cr (VI) oder Chrom-6. Chrom kann in verschiedenen Oxidationszuständen existieren, aber die stabilsten und gemeinsamsten Zustände sind +3 und +6. Aber in hexavalenten Verbindungen befindet sich das Chrom im Wesentlichen im Oxidationszustand von +6.
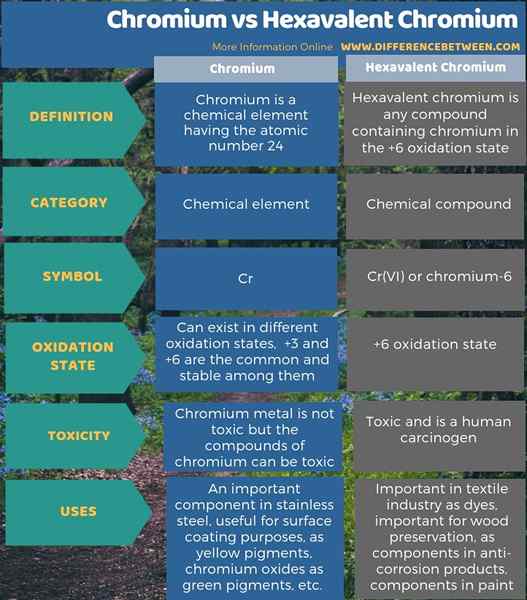
Zusammenfassung -Chrom gegen hexavalente Chrom
Chrom ist ein chemisches Element mit Atomzahl 24. Der Schlüsselunterschied zwischen Chrom und hexavalentem Chrom besteht darin.
Referenz:
1. West, Larry. „Was ist Chrom-6?”Thoughtco, Mar. 4, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Laidlaw Schulbus" (öffentlich zugänglich) über Commons Wikimedia
2. "Chrom (vi) -oxid" von BXXXXD-eigene Arbeit (CC BY-SA 3.0) über Commons Wikimedia


