Unterschied zwischen klassischer und nicht klassischer Carbokation
Der wichtigste Unterschied zwischen klassischer und nicht klassischer Carbokation ist das Klassische Carbokationen haben ein Kohlenstoffatom mit sechs Elektronen in drei chemischen Bindungen, während nichtklassische Karbokalte eine Drei-Zentrum-Zwei-Elektronen-Struktur aufweisen.
Eine Carbokation ist eine chemische Spezies, die eine Einheit eines organischen Moleküls ist. Es hat eine positive Ladung für ein Kohlenstoffatom. Ein einfaches Beispiel für eine Carbokation ist CH3+. Einige Carbokationen haben mehr als eine positive Ladung, auf demselben Kohlenstoffatom oder einem anderen Atom. Darüber hinaus sind Karbokationen aufgrund des Vorhandenseins einer positiven Ladung reaktive Zwischenprodukte bei organischen Reaktionen; Es gibt sechs Elektronen in einem Kohlenstoffatom, was es instabil macht (das Vorhandensein von acht Elektronen sorgt für die Stabilität); Daher neigt es dazu, Elektronen zu suchen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist klassische Carbokation
3. Was ist nicht klassisches Carbocation
4. Nebenseitiger Vergleich - Klassische vs nicht klassische Carbokation in tabellarischer Form
5. Zusammenfassung
Was ist klassische Carbokation?
Eine klassische Carbokation ist ein Ion, das ein positiv geladenes Kohlenstoffatom enthält, das sechs Elektronen hat, die an drei chemischen Bindungen teilnehmen. Wir können dieses Kohlenstoffatom als drei koordinierten positiven Kohlenstoff nennen.
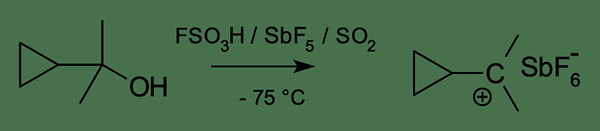
Abbildung 01: Bildung einer klassischen Carbokation
Um eine maximale Stabilität zu gewährleisten, sollte das Kohlenstoffatom acht Valenzelektronen haben. In der Carbokation gibt es jedoch nur sechs Elektronen im Kohlenstoffatom mit einer positiven Ladung. Daher neigt es dazu, zwei weitere Elektronen von einer elektronegativen Spezies zu teilen. Dies macht das Kohlenstoffatom stabil und neutralisiert die positive Ladung. Dies ist der Grund für die hohe Reaktivität klassischer Carbokationen. Die Energie einer klassischen Carbokation ist jedoch im Vergleich zu der Energie der entsprechenden nicht klassischen Carbokation niedrig. Aber dieser Unterschied in ihren Energien ist sehr klein.
Was ist nicht klassisches Carbocation?
Eine nichtklassische Carbokation ist ein Ion, das einen positiv geladenen Kohlenstoff in einem Drei-Zentrum-Zwei-Elektronen-Zentrum enthält. Dies bedeutet, dass es drei Atome gibt, die zwei Elektronen in diesen Karabokationen teilen. Diese Art der Elektronenfreigabe wird als Delokalisierung der Elektronen bezeichnet.

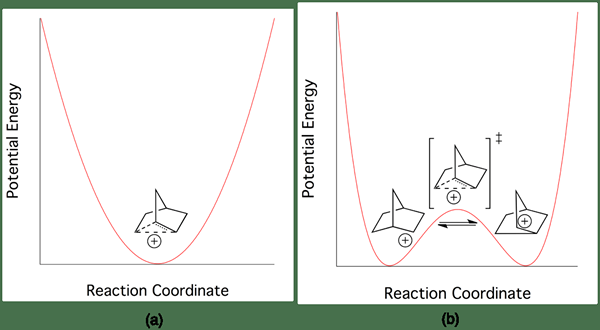
Abbildung 02: Energieunterschied zwischen klassischen und nicht klassischischen Karbokationen
Das häufigste Beispiel für eine nicht klassische Carbokation ist 2-Norbornylkation. Es existiert in einer weniger symmetrischen Drei-Zentrum-Zwei-Elektronen-Struktur. Die Energie zwischen klassischen und nicht klassischischen Karbokationen gibt nur sehr geringe Unterschiede. Daher ist es sehr schwierig, sie experimentell zu unterscheiden.
Was ist der Unterschied zwischen klassischer und nicht klassischer Carbokation?
In Abhängigkeit von der chemischen Struktur können wir Karobokationen in zwei Gruppen als klassische und nichtklassische Karobokationen klassifizieren. Der wichtigste Unterschied zwischen klassischer und nicht klassischer Carbokation besteht darin, dass klassische Karbokationen ein Kohlenstoffatom mit sechs Elektronen in drei chemischen Bindungen aufweisen, während nicht klassische Carbokationen drei Zentrum mit zwei Elektronen aufweisen. Die Energie der nicht klassischen Carbokation ist höher als die Energie der klassischen Carbokation, aber der Unterschied zwischen diesen Energien ist sehr gering; Daher ist es sehr schwierig, den Unterschied zwischen klassischen und nicht klassischen Strukturen zu unterscheiden.
Darüber hinaus ist die Aktivierungsenergie für die Umwandlung der klassischen Carbokation in eine nicht klassische Carbokation oder umgekehrt sehr klein. Zusätzlich zu diesen haben klassische Carbokationen die positive Ladung für das Kohlenstoffatom und die NOD -Elektronenpaare rund um das Kohlenstoffatom, aber in nicht klassischischen Karbokationen werden die Elektronen um das Kohlenstoffatom um Delokalisierung delokalisiert. Ein Beispiel für eine klassische Carbokation ist Metheniumion, während ein Beispiel für eine nichtklassische Carbokation 2-Norborylion ist.

Zusammenfassung - klassischer vs
Wir können die Karobokationen in zwei Gruppen als klassische und nichtcalsische Karbokalation in Abhängigkeit von der chemischen Struktur klassifizieren. Der wichtigste Unterschied zwischen klassischer und nicht klassischer Carbokation besteht darin, dass klassische Karbokationen ein Kohlenstoffatom mit sechs Elektronen in drei chemischen Bindungen aufweisen, während nicht klassische Carbokationen drei Zentrum mit zwei Elektronen aufweisen. Ein Beispiel für eine klassische Carbokation ist Metheniumion, während ein Beispiel für eine nicht klassische Carbokation 2-Norborylion ist.
Referenz:
1. „Carbocations.”Chemistry Libretexten, 5. Juni 2019, hier erhältlich.
2. "Carbocation". Wikipedia.Org, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Das Cyclopropylcarbinylkation" von V8RIK in englischer Wikipedia (CC BY-SA 3.0) über Commons Wikimedia
2. "Norbornyl Cation Single Well vs Double Well Potenzial" von JCAL730 - eigene Arbeit (Public Domain) über Commons Wikimedia


